
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的化学方程式(离子反应需写离子方程式):
(1)Fe2O3(Al2O3)_________________________________________________;
方程式________________________________________________________。
(2)Fe2O3[Fe(OH)3]______________________________________________;
方程式_________________________________________________________。
(3)FeSO4溶液(CuSO4)___________________________________________ __;
方程式__________________________________________________________。
(4)FeCl3溶液(FeCl2)________________________________________________;
方程式________________________________________________________。
【答案】(1)加足量氢氧化钠溶液溶解,然后过滤(1分) Al2O3+2OH===2![]() +H2O(2分)
+H2O(2分)
(2)加热(1分) 2Fe(OH)3![]() Fe2O3+3H2O(2分)
Fe2O3+3H2O(2分)
(3)加足量铁粉,充分反应后过滤(1分) Cu2++Fe===Fe2++Cu(2分)
(4)加入氯水或通入氯气(1分) 2Fe2++Cl2===2Fe3++2Cl(2分)
【解析】解答除杂题时要考虑除杂原则:除去杂质而不能引入新的杂质,同时考虑主要成分和杂质在性质上的差异,能用物理方法除去就选择物理方法除去,不能用物理方法可选择化学方法。
(1)因Fe2O3不溶于水,不与碱反应,而Al2O3溶于强碱溶液,所以可以用NaOH溶液除去。
(2)因Fe(OH)3不稳定,受热分解生成Fe2O3,可以用加热方法除去Fe(OH)3。
(3)Fe可以置换出Cu,可以加入Fe除去CuSO4。
(4)Fe2+与Fe3+可以相互转化,加入强氧化剂可以把Fe2+氧化生成Fe3+,所以通入Cl2把FeCl2氧化成FeCl3。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中地理 来源: 题型:
【题目】(1)从氧化还原的角度分析水在下列化学反应中的作用(从氧化剂、还原剂角度分析)。
①电解水:_____________________________________________________。
②钠和水的反应(2Na+2H2O![]() 2NaOH+H2↑):_______________________________。
2NaOH+H2↑):_______________________________。
③氟气和水反应(2F2+2H2O![]() 4HF+O2):_______________________________。
4HF+O2):_______________________________。
④氯气和水反应(Cl2+H2O![]() HCl+HClO):______________________________。
HCl+HClO):______________________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应体系中还原产物是________;若反应中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl===NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A.①④⑤ B.②③④ C.①③⑤ D.③④⑤
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某课外活动小组设计以下装置进行实验:
(1)按如图所示装置进行实验,填写有关现象及化学方程式。

①B中浓硫酸的作用是__________________________________。
②C中发生反应的化学方程式为______________________________________________________。
③D中的现象是___________________________________________。
④E中收集的气体是________。
(2)用如下图所示装置制取纯净的O2。
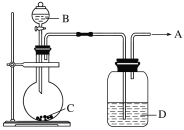
①若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是______________________。
②若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
③洗气瓶(广口瓶)中装的试剂D的作用是_____________________。所制得的气体用________法收集。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016新课标Ⅰ]298 K时,在20.0 mL 0.10 mol![]() 氨水中滴入0.10 mol
氨水中滴入0.10 mol![]() 的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol![]() 氨水的电离度为1.32%,下列有关叙述正确的是
氨水的电离度为1.32%,下列有关叙述正确的是

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl)=c(H+)=c(OH)
D.N点处的溶液中pH<12
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y |
|
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为__________________________。
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3,还含有的离子有_________________。
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为_______________。沉淀转化的主要原因是______________。
(4)已知:Ag+ + 2NH3· H2O ![]() Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
(5)结合上述信息分析,下列预测不正确的是 。
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下列反应中,既是化合反应又是氧化还原反应的是
A.二氧化硫催化氧化成三氧化硫:2SO2+O2![]() 2SO3
2SO3
B.氯气通入溴化钠溶液中:Cl2+2NaBr![]() 2NaCl+Br2
2NaCl+Br2
C.稀盐酸与硝酸银溶液混合反应:HCl+AgNO3![]() AgCl↓+HNO3
AgCl↓+HNO3
D.氧化钠跟水反应:Na2O+H2O![]() 2NaOH
2NaOH
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图所示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是:______________;在X极附近观察到的现象是:__________________。
②Y电极上的电极反应式是:_____________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_____;
②Y电极的电极反应式是_____________________。(不考虑杂质反应)
(3)若要在铁钉表面镀铜,X电极的材料是_____。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】
Never before seen anybody who can play tennis as well as Robert.
A. had she
B. she had
C. has she
D. she has
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com