
【题目】在氯化铁溶液中存在下列平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl ΔH>0。
Fe(OH)3+3HCl ΔH>0。
回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液体中加入MgCl2溶液,产生的现象为_________________________。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是________。
(3)在配制FeCl3溶液时,为防止浑浊,应加入________。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是______________________________________________。
【答案】(1)生成红褐色沉淀 (2)Fe2O3 (3)少许浓盐酸
(4)MgCO3促进了Fe3+的水解,使Fe3+转化为Fe(OH)3沉淀而被除去
【解析】(1)加热FeCl3溶液,得到Fe(OH)3胶体,加入电解质MgCl2使胶体聚沉而得到红褐色沉淀。
(2)加热可促进盐类水解,由于HCl挥发,可使水解进行彻底,得到Fe(OH)3沉淀,Fe(OH)3受热分解,最终产物为Fe2O3。
(3)为防止浑浊,应加入浓盐酸抑制FeCl3水解。
(4)MgCO3与水解产生的H+反应:MgCO3+2H+===Mg2++CO2↑+H2O,使水解平衡正向移动,生成的Fe(OH)3在加热搅拌条件下发生聚沉,在过滤时Fe(OH)3和未反应的MgCO3一同被除去。


科目:高中地理 来源: 题型:
【题目】某有机物含有C、H、O、N四种元素,下图是该有机物的球棍模型:
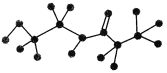
(1)该有机物的分子式为________,结构简式为__________________。
(2)该有机物可能发生的反应有________(填编号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应 ⑥缩聚反应
(3)该有机物发生水解反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )

A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在稀硫酸、碳酸钠、二氧化碳、铜片、氢氧化钡、氢氧化钠、生石灰、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应。
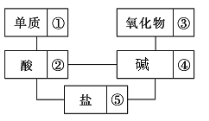
(1)请推断出它们的化学式分别为:
①_______; ②_______; ③________;④________; ⑤_______。
(2)写出下列序号之间反应的化学方程式:
①和②: ____________________________________________;
②和④: ____________________________________________;
②和⑤: ____________________________________________;
④和⑤: ____________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2溶液、盐酸四种无色溶液中的一种,现进行了如图1所示的实验。
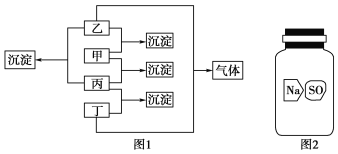
(1)通过上述实验判断出各物质:甲________、乙________、丙________、丁________。写出甲与乙反应的离子方程式______________________。
(2)实验室有一瓶标签破损(如图2所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?________。若正确,请写出相应的离子反应方程式;若不正确,请说明可能的结论,并给出进一步验证的实验方案(要求:所用试剂只能从甲、乙、丙、丁中选用):__________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)常温时向水中加入少量固体MgCl2,________(填“促进”或“抑制”)了水的电离;与纯水相比,所得溶液中KW________(填“变大”“变小”或“不变”)。
(2)现有下列溶液:①20 mL 0.1 mol·L-1 H2SO4溶液;②40 mL 0.1 mol·L-1 CH3COOH溶液;③40 mL 0.1 mol·L-1 HCl溶液;④40 mL 0.1 mol·L-1 NaOH溶液;⑤20 mL 0.1 mol·L-1 Ba(OH)2溶液,其中:
A.c(H+)最小的是________(填序号)
B.任取2份溶液混合,混合溶液的pH为7,有________种取法。
C.②④混合后,溶液的pH________7(填“大于”“小于”或“等于”)。
D.混合后出现白色沉淀的两种溶液是________。(填序号)
(3)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。则:
①B是________溶液,C是________。
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=________(填数据)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)。已知:平均反应速率vC=
pC(g)+qD(g)。已知:平均反应速率vC=![]() vA;反应2 min时,A的浓度减少了
vA;反应2 min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=________。
(2)化学方程式中,x=________,y=__________,p=__________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0。(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”“减小”或“不变”),理由是____________________________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是_________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知在相同条件下电离常数有如下关系:Ka1(H2CO3)>Ka(HBrO)>Ka2(H2CO3)。下列离子方程式或化学方程式中不正确的是
A.向NaHCO3溶液中滴加少量溴水:![]() +Br2
+Br2![]() HBrO+Br+CO2↑
HBrO+Br+CO2↑
B.向Na2CO3溶液中滴加少量溴水:2![]() +Br2+H2O
+Br2+H2O![]() BrO-+Br-+2
BrO-+Br-+2![]()
C.向NaBrO溶液中通入少量的CO2:CO2+NaBrO+H2O![]() NaHCO3+HBrO
NaHCO3+HBrO
D.向NaBrO溶液中通入足量的CO2:CO2+2NaBrO+H2O![]() Na2CO3+2HBrO
Na2CO3+2HBrO
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的化学方程式(离子反应需写离子方程式):
(1)Fe2O3(Al2O3)_________________________________________________;
方程式________________________________________________________。
(2)Fe2O3[Fe(OH)3]______________________________________________;
方程式_________________________________________________________。
(3)FeSO4溶液(CuSO4)___________________________________________ __;
方程式_________________________________________________________。
(4)FeCl3溶液(FeCl2)________________________________________________;
方程式________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com