
【题目】(1)从氧化还原的角度分析水在下列化学反应中的作用(从氧化剂、还原剂角度分析)。
①电解水:_____________________________________________________。
②钠和水的反应(2Na+2H2O![]() 2NaOH+H2↑):_______________________________。
2NaOH+H2↑):_______________________________。
③氟气和水反应(2F2+2H2O![]() 4HF+O2):_______________________________。
4HF+O2):_______________________________。
④氯气和水反应(Cl2+H2O![]() HCl+HClO):______________________________。
HCl+HClO):______________________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应体系中还原产物是________;若反应中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
【答案】(1)①既作氧化剂,又作还原剂 ②作氧化剂 ③作还原剂 ④既不作氧化剂,也不作还原剂
(2)NO 4.8
(3)Fe2+>Br>Cl 2Fe2++4Br+3Cl2![]() 2Fe3++2Br2+6Cl
2Fe3++2Br2+6Cl
【解析】(1) 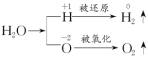
所以在反应①中H2O既作氧化剂又作还原剂,在反应②中水只作氧化剂,在反应③中H2O只作还原剂,在反应④中H2O既不作氧化剂也不作还原剂。
(2)由于HNO3具有强氧化性,H2S具有还原性,此反应为HNO3将H2S氧化成S,自身被还原为NO,转移2 mol e时生成32 g S,当转移0.3 mol电子时,得到S的质量为4.8 g。
(3)Fe2+、Br均具有还原性,当通入少量Cl2时只有Fe2+被氧化,说明还原性Fe2+>Br>Cl,当通入足量Cl2时,Fe2+和Br将按1∶2完全被氧化,离子方程式为2Fe2++4Br+3Cl2![]() 2Fe3++2Br2+6Cl。
2Fe3++2Br2+6Cl。


科目:高中地理 来源: 题型:
【题目】如图是某同学利用注射器设计的简易实验装置。甲管中吸入10 mL CH4,同温同压下乙管中吸入50 mL Cl2,将乙管气体推入甲管中,将注射器用日光照射一段时间。
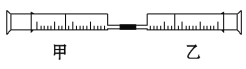
(1)下列是某同学预测的实验现象:
①气体最终变为无色;
②实验过程中,甲管活塞向内移动;
③甲管内壁有油珠;
④产生火花。
其中正确的是 。
(2)甲管中发生的化学反应类型为 。
(3)反应后,甲管中剩余气体最好用下列的 吸收。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到 ,若用pH试纸测量甲管中溶液的酸碱性,可观察到pH试纸变 色。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料,“在加热情况下卤素与碱液发生如下反应:3X2+6OH![]() 5X+
5X+![]() +3H2O”。
+3H2O”。

回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为_______________________。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?________(填“能”或“不能”,下同),理由是__________________________________________。

(3)装置中能否省去盛浓硫酸的洗气瓶?________,理由是____________________________。
(4)装置中能否省去盛冰水的烧杯?________,理由是______________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的______作氧化剂。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目: 。
(4)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 L。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:____________________________。
(2)试配平:_______Fe2++_______![]() +_______ ===_______Fe3++_______Cr3++_______H2O
+_______ ===_______Fe3++_______Cr3++_______H2O
(3)若该废水经处理后Cr3+的含量为1×102 mol·m3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm3)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、![]() 、
、![]() 、
、![]() 、K+、Na+。为确认溶液组成进行如下实验:
、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气
体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有 ,可能存在的离子有 ;
(2)原溶液中c(![]() )为 ,c(
)为 ,c(![]() ) c(
) c(![]() ) (填“>、<或=”);
) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl) c(![]() ) (填“>、<或=”)。
) (填“>、<或=”)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016上海](1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[![]() ]>[
]>[![]() ]
]
b.[![]() ]>[HC2O4-]>[C2O42-]>[
]>[HC2O4-]>[C2O42-]>[![]() ]
]
c.[H+]>[HC2O4-]>[C2O42-]>[![]() ]
]
d.[H2CO3] >[![]() ]>[HC2O4-]>[
]>[HC2O4-]>[![]() ]
]
(2)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的化学方程式(离子反应需写离子方程式):
(1)Fe2O3(Al2O3)_________________________________________________;
方程式________________________________________________________。
(2)Fe2O3[Fe(OH)3]______________________________________________;
方程式_________________________________________________________。
(3)FeSO4溶液(CuSO4)___________________________________________ __;
方程式__________________________________________________________。
(4)FeCl3溶液(FeCl2)________________________________________________;
方程式________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com