
【题目】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:![]()
方案二:![]()
(1)从节约药品的角度思考,你认为哪一种方案好?_____________,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
【答案】(1)方案二较好 方案一在加入NaOH溶液和方案二在加入H2SO4溶液时,均难以控制加入的量以确保Al元素全部沉淀。
(2)将Al按1∶3分成两份,第一份与硫酸溶液反应,第二份与NaOH溶液反应,然后将所得溶液混合即可。有关反应的化学方程式为:
2Al+3H2SO4===Al2(SO4)3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2(SO4)3+6NaAlO2+12H2O===8Al(OH)3↓+3Na2SO4
【解析】(1)设同样制备1 mol Al(OH)3,根据设计的方案中涉及的反应计算,方案一需1 mol Al、1.5 mol H2SO4、3 mol NaOH,方案二需1 mol Al、0.5 mol H2SO4、1 mol NaOH,故方案二比方案一节约药品。但方案一加入NaOH溶液和方案二中加入H2SO4溶液时,均难以控制加入的量以确定Al元素全部进入沉淀。
(2)按下图,将1 mol Al分成两部分去做,将所得溶液合并:
1 mol Al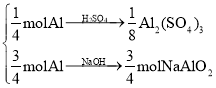
1 mol Al(OH)3。
实验中只需1 mol Al、0.375 mol H2SO4、0.75 mol NaOH,且无需担心Al元素不能全部进入沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中地理 来源: 题型:
【题目】如图甲所示为观察电容器放电的电路。先将开关S拨到1端,再拨到2端,得到了如图乙所示的电流随时间变化的曲线。下列说法正确的是
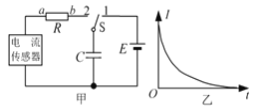
A.开关拨到1端后,电容器的上极板带负电
B.开关拨到1端后,电源对电容器的充电电流恒定
C.开关拨到2端后,有电流从b到a流过电阻R
D.开关拨到2端后,电容器的放电电流随时间均匀减小
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)BiCl3的水解产物中有BiOCl生成。
①写出BiCl3水解反应的方程式:_________________________。
②医药上将BiOCl称为次氯酸铋,该名称____________(填“正确”或“不正确”)。
③如何配制BiCl3溶液?_________________________________。
(2)将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
①若生成的盐中只有一种离子水解,该离子水解的离子方程式为_____________________。
②简述该混合液呈碱性的原因______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(13分)一辆值勤的警车停在公路边,当警员发现从他旁边以10 m/s的速度匀速行驶的货车严重超载时,决定前去追赶,经过5.5 s后警车发动起来,并以2.5 m/s2的加速度做匀加速运动,但警车的行驶速度必须控制在90 km/h 以内。问:
(1)警车在追赶货车的过程中,两车间的最大距离是多少?
(2)判定警车在加速阶段能否追上货车?(要求通过计算说明)
(3)警车发动后要多长时间才能追上货车?
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成分判断正确的是( )
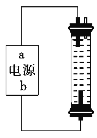
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】现用0.1 mol/L的AlCl3溶液和0.1 mol/L的氢氧化钠溶液,进行下面的实验。
在试管中盛有上述AlCl3溶液10 mL,向其中逐滴滴入上述的NaOH溶液。
(1)加入10 mL NaOH溶液时的现象是________,加入30 mL NaOH溶液时的现象是________,加入35 mL NaOH溶液时的现象是____________________。
(2)生成沉淀质量最多时,需NaOH溶液________mL。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
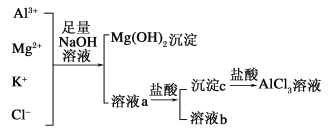
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
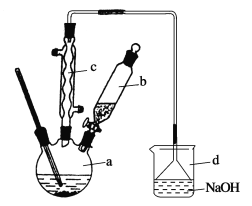
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是______________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______________,要进一步提纯,下列操作中必须的是___________(填入正确选项前的字母);
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】利用实验室常用的物品,根据电化学原理,可以设计原电池。请填写下列空白:
(1)实验原理:Fe+2H+= 。
(2)实验用品:电极( 、 )(填所用电极的名称)、稀硫酸、烧杯、导线、耳机(或电流计)。
(3)实验装置如图所示。
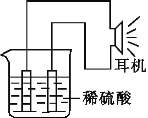
(4)原电池工作原理分析:
该原电池工作时,负极为 (填化学式),发生 (填“氧化”或“还原”),其电极反应式为 ,另一电极为正极,发生 反应,其电极反应式为 ,外电路中电子流动方向为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com