
【题目】My schedule is very___right now,but I’ll try to fit you in
A.tight
B.short
C.regular
D.flexible
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中地理 来源: 题型:
【题目】在铁制品上镀上一层锌层,以下电镀方案中合理的是( )
A.锌作阳极,铁制品作阴极,溶液中含Fe2+
B.锌作阴极,铁制品作阳极,溶液中含Zn2+
C.锌作阴极,铁制品作阳极,溶液中含Fe3+
D.锌作阳极,铁制品作阴极,溶液中含Zn2+
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】The monitor___the examination papers to the students
A.collected
B.distributed
C.reported
D.presented
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(双选)下列物质分类合理的是( )
A.根据物质组成中是否含有碳元素,将物质分为无机物和有机物
B.HCOOCH3、CH3OCHO--互为同分异构体
C.HCOOH、C15H31COOH--互为同系物
D.天然油脂的分子中含有酯基,属于酯类
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是___________,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是__________________。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中_____________。(填字母)
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
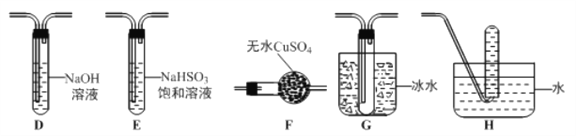
①丙组同学的实验装置中,依次连接的合理顺序为 _______________。
②能证明绿矾分解产物中有O2的实验操作及现象是_______________ 。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、_______________ ;选用的试剂为_______________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq)![]() Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。

请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为_________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:
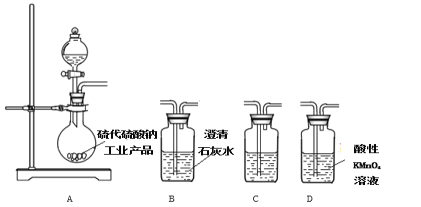
①实验装置的连接顺序依次________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】煤变油,是指以粉煤和水(比例为1:2.5)为原料制取汽油、柴油、液化石油气的技术。南非是世界上率先掌握煤变油先进技术的国家之一。读图,回答下列问题。
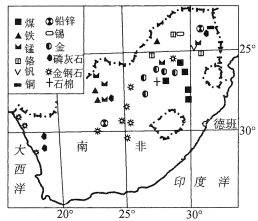
【1】南非率先掌握先进煤变油技术的地理背景是
A.石油资源十分短缺
B.靠近欧洲油气市场
C.油品输出较煤炭输出利润大
D.输油管道密集,油气运输方便
【2】南非发展“煤变油”的主要制约因素是
A.煤炭资源有限
B.环境污染严重
C.水资源不足且分布不均
D.劳动力和资金短缺
【3】下列关于南非渔业资源丰富的海域及其成因的叙述,正确的是
A.东部较西部丰富是由于大陆架较西部宽广
B.西部较东部丰富是由于光照较东部强
C.东部较西部丰富是由于东部受寒暖流交汇的影响
D.西部较东部丰富是由于西部受上升流的影响
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】甲乙两同学分別对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置己略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4
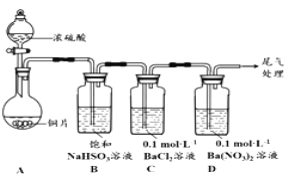
①A中反应的化学方程式是______________________。
②为探究SO2在D中所发生反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价硫元素的物质性质进行探究。
序号 | 实验操作 | 实验现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大重白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:____________________。
②由实验1、2、3对比,可以得到推论:____________________。
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取_______固体混合物,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii实验1和4对比,乙获得推论:_____________________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加_________(填字母序号)
a. 2mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b. 2mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c. 2mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d. 2mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,S、O、N三种元素的电负性由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2,CN中提供孤电子对的原子是______,1 mol CN中含有的π键的数目为_________。与CN互为等电子体的离子有_________ (写出一种即可)。
(3)已知AlCl3的蒸气是缔合的双分子(Al2Cl6),更高温度下Al2Cl6则离解生成AlCl3单分子。单分子AlCl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_____。
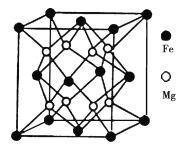
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为d nm,则该合金的密度为____________ g/cm3 (不必化简,用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com