
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1 所示),并测定电离平衡常数Kb。
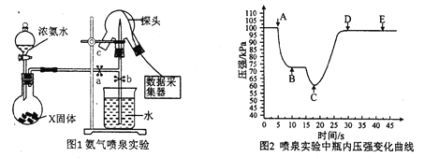
(1)实验室制取氨气的化学方程式为_____________;
图1 中用浓氨水和X 固体快速制取NH3,X固体不可以是________(填序号)
A.生石灰 B.无水氯化钙 C.烧碱 D.碱石灰
(2)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c 口,_______(填操作)可引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2 所示。图2中________点时喷泉喷的最剧烈。
(3)喷泉实验结束后,发现水未充满三颈烧瓶(大约占体积的90 % ) ,如装置的气密性良好,烧瓶未充满水的原因是________________,所得氨水的物质的量浓度为________。
(4)从三颈瓶中用__________(填仪器名称)量取25. 00 mL氨水至锥形瓶中,用0.0500mol/LHCl 滴定测定氨水的浓度。用pH 计采集数据、电脑绘制滴定曲线如图3 所示。
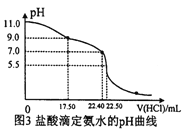
当pH=11.0时,NH3·H2O电离平衡常数Kb的近似值,Kb≈_________。
(5)关于该滴定实验的说法中,正确的是_______(填序号)
A. 锥形瓶中有少量蒸馏水不影响测定结果
B.选择酚酞作为指示剂,测定结果偏高
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.滴定终点时俯视读数会导致测定结果偏高
【答案】(15分)(1)2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;(2分)B(1分);
CaCl2+2H2O+2NH3↑;(2分)B(1分);
(2)打开b,挤压胶头滴管使水进入烧瓶;(2分)C(1分);
(3)氨气中混有空气(2分);0.045mol/L(1分);
(4)碱式滴定管(或20mL移液管)(2分);2.2×10-5(2分);
(5)A(2分);
【解析】(1)利用消石灰与NH4Cl固体混合加热制氨气,发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;浓氨水易挥发,生石灰、烧碱和碱石灰溶于水放出大量的热,能够促进氨气的逸出,而无水氯化钙能够与氨气反应,所以不能用来制氨气;
CaCl2+2H2O+2NH3↑;浓氨水易挥发,生石灰、烧碱和碱石灰溶于水放出大量的热,能够促进氨气的逸出,而无水氯化钙能够与氨气反应,所以不能用来制氨气;
(2)要形成喷泉实验,应使瓶内外形成负压差,而氨气极易溶于水,所以打开b,挤压胶头滴管使水进入烧瓶,氨气溶于水,使瓶内压强降低,形成喷泉;三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,C点压强最小、大气压不变,所以大气压和C点压强差最大,则喷泉越剧烈;
(3)装置的气密性良好,烧瓶未充满水说明氨气中混有空气,假设氨气的体积为VL,则氨水的体积也为VL,氨气的物质的量为VL÷22.4L/mol=V/22.4mol,所得氨水的物质的量浓度为V/22.4mol÷VL=0.045mol/L;
(4)氨水显碱性,量取碱性溶液,应选择碱式滴定管;氨水的物质的量浓度为0.045mol/L,pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3H2O)≈0.0450mol/L,根据Kb=![]() ==2.2×10-5;
==2.2×10-5;
(5)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量,所以不影响测定结果,故A正确;B.酚酞为碱性指示剂,滴定终点时消耗盐酸的体积偏低,测定浓度偏低,故B错误;C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低,则使用盐酸的体积偏大,所以导致测定结果偏高,故C错误;D.滴定终点时俯视读数会导致盐酸体积偏小,则盐酸物质的量偏小,测定结果偏低,故D错误;故选A。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中地理 来源: 题型:
【题目】Mothers holding jobs outside the home should have___schedules to make it easier to care for their children
A.heavy
B.smooth
C.flexible
D.complex
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】一支规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
A.流出溶液的体积为(m-n)mL
B.流出溶液的体积为(n-m)mL
C.管内溶液体积等于(a-n)mL
D.管内溶液体积多于n mL
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】食醋的总酸量即一定体积的食醋原液所含醋酸的质量,单位是g· L-1或个g/100mL。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是 。
A.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
B.食醋样品不需要预先稀释一定倍数后可以直接进行滴定
C.用NaOH溶液滴定时,可使用酚酞或甲基橙作指示剂
D.若测得样品的物质的量浓度为0.75mol·L-1,则其总酸量为45g·L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有作为食品添加剂的苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的 。
A.pH B.电离度 C.电离常数 D.溶解度
(3)常温下,用0.1000mol· L-1 NaOH溶液分别滴定20.00mL 0.1000mol· L-1 HCl溶液和20.00mL 0.1000mol· L-1 CH3COOH溶液,得到两条滴定曲线,如图所示。

①滴定醋酸溶液的曲线是 (填“图1”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因是(用离子方程式表示): 。
(4)测定食醋的总酸量实验中,配制NaOH溶液和稀释食醋所用的蒸馏水必须煮沸,目的是 。
(5)实验时,吸取食醋样品10mL于100mL容量瓶中定容。移取定容后的溶液20mL于锥形瓶中,加入1~2滴指示剂,用浓度为c mol·L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL。则原食醋样品的总酸量=____________g/100mL。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________________
(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
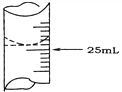
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。
(2)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是__________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)________。
A. 是amL B.是(50-a)mL C. 一定大于amL D.一定大于(50-a)mL
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的____________,(填写“甲”、“乙”、“丙”)然后轻轻挤压玻璃球使尖嘴部分充满碱液。


(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
A.根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数____________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积____________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察_____________。(填“A”或“B”)
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由___________色变成___________色。
B.滴定结果如下表所示:
滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mo1·L-1,则该样品中氮的质量分数为_______________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图某国的某类生产厂的分布图,读图回答下列各题。
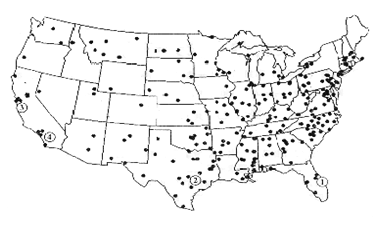
【1】该工业的布局属于
A.资源指向型 B.市场指向型
C.技术指向型 D.动力指向型
【2】该工业最有可能是
A.飞机制造工业 B.钢铁工业
C.瓶装饮料工业 D.高档时装工业
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是( )
加入的物质 | 结论 | |
A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为某城市规划草图,该市常年盛行东北风。读图并结合所学知识,完成问题。

【1】图中①、②、③、④表示不同的功能区,则①、②、③、④分别为( )
A.文教区、工业区、住宅区、商业区 B.住宅区、工业区、文教区、商业区
C.商业区、工业区、文教区、住宅区 D.住宅区、商业区、工业区、文教区
【2】该市计划在图中甲、乙、丙、丁四地选择一处建设钢铁厂,最佳的地点是( )
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com