
【题目】某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是 。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是 。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和 的洗气瓶。
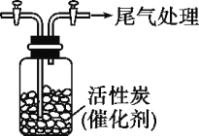
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究。
(1)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,证明无色液体是SO2Cl2。
①写出SO2Cl2与H2O反应的化学方程式: 。
②检验该溶液中Cl-的方法是 。
(2)继续研究反应进行的程度。用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
①该白色沉淀的成分是 。
② 写出SO2与Cl2反应的化学方程式,并阐述理由
【答案】Ⅰ.+6价
Ⅱ.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
Ⅲ.浓硫酸
Ⅳ.(1)①SO2Cl2+2H2O![]() H2SO4+2HCl
H2SO4+2HCl
②取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-
(2)①BaSO4
②SO2+Cl2![]() SO2Cl2;由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体。因此SO2和Cl2生成SO2Cl2的反应为可逆反应
SO2Cl2;由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体。因此SO2和Cl2生成SO2Cl2的反应为可逆反应
【解析】Ⅰ.在化合物中,各元素的化合价的代数和为0。化合物SO2Cl2中氧元素为-2价,Cl元素为-1价,故S元素的化合价是+6价。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
Ⅲ.在收集氯气前,应先通过饱和食盐水除去氯气中的氯化氢,再通过浓硫酸除去氯气中的水蒸气。
Ⅳ.(1)①SO2Cl2与H2O反应的化学方程式为SO2Cl2+2H2O![]() H2SO4+2HCl;
H2SO4+2HCl;
②溶液中存在SO42-和Cl-,因SO42-与Ag+反应也能产生白色沉淀,干扰Cl-的检验,所以在检验Cl-之前必须将SO42-除去。
(2)因反应后产生了白色沉淀,所以分离后的气体中必定含有SO2和Cl2,即SO2与Cl2生成SO2Cl2的反应为可逆反应。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中地理 来源: 题型:
【题目】已知X、Y、Z为单质,其他为化合物。其中Y为气体,G溶液呈黄色,E是不溶于水的酸性氧化物,能与氢氟酸反应,它们之间存在如图所示的转化关系(部分产物已略去)。
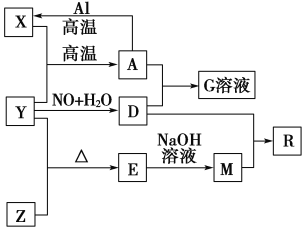
请回答下列问题:
(1)写出物质E的一种用途:_________________________________________。
(2)写出A和D的稀溶液反应生成G的离子方程式:_____________________。
(3)向含4 mol D的稀溶液中,逐渐加入X粉末至一定量。假设D完全反应且生成的气体只有一种,则反应的X的物质的量范围为________mol。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】落户湖北省黄石市黄石港区江北工业园的中国-东盟北斗科技城(左图),计划建成面向全球、特别是以泰国、马来西亚等国家为主的东盟地区,集北斗应用和服务产业体系、北斗产业孵化体系、科技体验和休闲观光体系、国际高端学术交流和技术外包服务体系等为一体的科技城(右图)。据此完成下列各题。
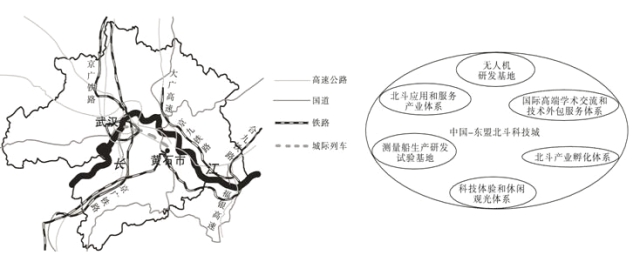
【1】测量船研发基地和无人机研发基地进入该科技城有利于
A.共同利用公共服务 B.及时把握研发动态
C.共同处理废弃物质 D.开拓产品销售市场
【2】中国-东盟北斗科技城的建设,有利于湖北省
A.提高城市化水平 B.开发能源矿产资源
C.缩小城乡间差异 D.促进产业结构升级
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
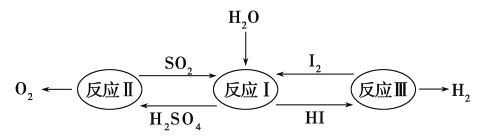
(1)反应Ⅰ的化学方程式是________________。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是________(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是____________________。
③经检测,H2SO4层中c(H+)∶c(SO![]() )=2.06∶1,其比值大于2的原因______________________。
)=2.06∶1,其比值大于2的原因______________________。
(3)反应Ⅱ:
2H2SO4(l)===2SO2(g)+O2+2H2O(g)
ΔH=+550 kJ·mol-1
它由两步反应组成:
ⅰ.H2SO4(l)===SO3(g)+H2O(g)
ΔH=+177 kJ·mol-1
ⅱSO3(g)分解。
L(L1,L2),X可分别代表压强或温度,下图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。
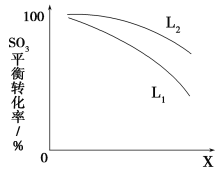
①X代表的物理量是________。
②判断L1,L2的大小关系,并简述理由:________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】A new___bus service of Tianjin Airport started to operate two months ago
A.normal
B.usual
C.regular
D.common
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】有资料认为NO、NO2不能与Na2O2反应。某小组学生提出质疑,从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出假设并进行探究:假设Ⅰ.Na2O2能氧化NO2
假设Ⅱ.NO2能氧化Na2O2
(1) 小组甲同学设计了如图实验装置,并进行如下实验:
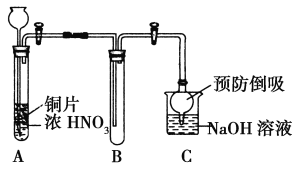
① 试管A中发生反应的化学方程式是______________________________。
② 待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带余烬的木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是___________________。
③ 乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;但带余烬的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是_____________________________。
(2) 丙同学认为NO易被O2氧化,更易被Na2O2氧化。
查阅资料:①2NO+Na2O2===2NaNO2
② 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O
③ 酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+
和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

① A装置中盛装Cu片的仪器名称是_____________________,B中观察到的主要现象是______________________,F装置的作用是______________________________。
② 在反应前,打开弹簧夹,通入一段时间N2,目的是______________________________。
③ 充分反应后,检验D装置中产物是NaNO2还是NaNO3的实验方法是_______________ _____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】三支体积相等的试管分别充满相同状态下气体:①氨气;②体积比为4∶1的NO2和O2气体;③NO2气体;将他们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体不扩散),则下列结论正确的是( )
A.①和③试管内溶液的体积不等,溶质的物质的量浓度也不相等
B.因为它们都可溶于水,所以液面都上升到试管顶部
C.三支试管中,试管②中溶液中溶质的物质的量浓度最小
D.试管②和试管③中溶液的溶质的物质的量浓度一定相等
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】We thought of selling this old furniture,but we decided to___it.It might be valuable
A.hold on to
B.keep up with
C.turn to
D.look after
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】阅读材料,回答下列问题。
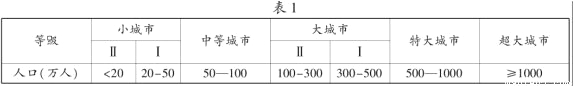
材料一、2014年10月29日,国务院印发《关于调整城市规模划分标准的通知》。新的城市规模划分标准以城区常住人口为统计口径,将城市划分为五类七档。
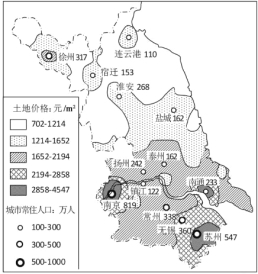
材料二、下图为某年江苏省城市地价及省辖市中心城市常住人口示意图。
(1)按新的城市规模划分标准,江苏省13个省辖市可分为_____ 类_____档,其中特大城市有_____个。
(2)江苏省各城市地价空间分布的大致趋势是_______________________,影响其形成的最主要因素是_______________________。
(3)图中有三个地价高值区,从城市职能看,南京为__________,从接受大城市辐射看,苏州为__________,从交通区位看,南通濒江达海,所以地价较高。
(4)从地价因素考虑,江苏省内工业为降低生产成本,可能由_________向__________转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com