
【题目】已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:![]() 、Ba2+、Na+、H+、
、Ba2+、Na+、H+、![]() 、
、![]() 、OH-、
、OH-、![]() 。将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是________,判断理由是_______________________________。
(2)写出其余几种物质的化学式:A________,B_________,C________。
(3)写出实验②中有关反应的离子方程式______________________。
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中地理 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论: 。
②以下同学们在实验中观察到的现象中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体, (填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据HCl计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 (写离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】树木年轮是气候变化的历史证据。读某地树木年轮示意图,回答下列各题。
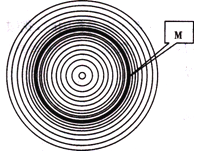
【1】图中反映了该地近百年气候变化,下列说法正确的是
A.寒冷——温暖——寒冷交替变化
B.温暖——寒冷——温暖交替变化
C.暖湿——暖干——暖湿交替变化
D.湿冷——干冷——湿冷交替变化
【2】引起其气候周期性变化的自然因子最可能的是
A.人类大量排放二氧化碳 B.黄赤交角的变化
C.太阳活动的周期变化 D.人类不断破坏森林
【3】在M时期,该地最可能出现的自然现象是( )
A.雪线上升 B.河流汛期延长
C.海平面下降 D.作物带面积扩大
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
实验 步骤 | 实验操作 |
Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
Ⅱ | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O22Fe2O3+4CO2
(1)写出实验步骤Ⅲ中发生反应的离子方程式____________________。
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是________(填序号)。
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是________________。
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、________(填名称)和________(填名称);再__________________(填操作名称)、灼烧,即可得到Fe2O3。
(5)工业上通过控制样品的质量,使滴定时消耗KMnO4溶液体积为c mL,菱铁矿中FeCO3的质量分数为c%,可以简化测量。某同学取含FeCO3 c%的菱铁矿a g,用足量稀硫酸溶解后,再用0.020 0 mol·L-1的酸性KMnO4溶液滴定(KMnO4被还原成Mn2+),最终消耗KMnO4溶液c mL。假定矿石中无其他还原性物质,则所取菱铁矿的质量a=________g。(FeCO3的摩尔质量为116 g·mol-1)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72 L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为( )
A.66.4 g B.50.8 g C.44.8 g D.39.2 g
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】读某国简图,完成下列各题。
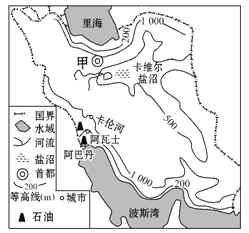
【1】下列有关图示内容的叙述,正确的是
A.图示地区多为平原
B.河流径流量季节变化大
C.城市都分布在石油产地
D.河流众多,水资源充足
【2】图中卡维尔盐沼的成因有 ①过度开采地下水,导致海水倒灌②山脉阻挡海洋水汽深入,气候干旱③地势四周高中间低④多外流河
A.①② B.①③ C.②③ D.③④
【3】沙特阿拉伯东西两侧临海,气候却非常干燥,其原因是
A.国土面积广大,工农业发达、耗水量太大
B.海水是咸的,从海洋上吹来的暖湿气流带来的降水也是咸的,不能用于生产和生活
C.地形以高原为主,北回归线穿过领土中部,且西部靠近有“高原大陆”之称的非洲
D.境内河流湖泊太少,不利于降水的储存,且地势西高东低
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】关于摩擦起电和感应起电,以下说法正确的是
A.摩擦起电是因为电荷的转移,感应起电是因为产生电荷
B.摩擦起电是因为产生电荷,感应起电是因为电荷的转移
C.不论摩擦起电还是感应起电都是电荷的转移
D.以上说法均不正确
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为“某市三个不同区域的土地利用结构图”。读图回答下列各题。
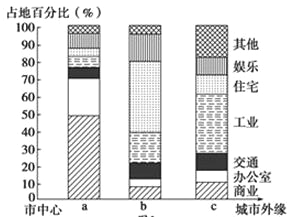
【1】三个区域中
A.工业污染最严重的是a
B.常住人口最多的是b
C.地价最高的是c
D.商业活动最为繁荣的是c
【2】以下地理事项最有可能位于a区域的是
A.大型批发零售市场 B.高级住宅区
C.疗养院 D.中心商务区
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si![]() 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)

①NH4Cl中的化学键类型有______________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是______________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______________________,实验室可利用如图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。

(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_________________________。
将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com