
【题目】1.为探究从镀银车间的废液中回收银的效果,某化学兴趣小组的同学在25 ℃时进行了下列分析:
(1)他们取了35 L Ag+浓度为6×103 mol·L1的某镀银车间回收液,然后加入0.012 mol·L1NaCl溶液25 L,此时 (填“能”或“不能”)观察到AgCl沉淀。
(2)最后该溶液中的c(Ag+)为 ,生成AgCl的质量为 。
(3)AgCl在上述溶液中的溶解度与在纯水中的相比, 中的溶解度较大。
[已知Ksp(AgCl)=1.8×1010]
【答案】(1)能 (2)1.2×107 mol·L1 30.1 g (3)纯水
【解析】(1)两溶液混合后Ag+和Cl的浓度都会减小,混合后c(Ag+)=![]() =3.5×103 mol·L1、c(Cl)=
=3.5×103 mol·L1、c(Cl)=![]() =5.0×103 mol·L1,Qc= c(Ag+)·c(Cl) = 3.5 × 103 × 5.0 × 103 = 1.75×105>Ksp(AgCl),故有沉淀生成。
=5.0×103 mol·L1,Qc= c(Ag+)·c(Cl) = 3.5 × 103 × 5.0 × 103 = 1.75×105>Ksp(AgCl),故有沉淀生成。
(2)因为c(Ag+)<c(Cl),生成AgCl沉淀时Cl是过量的。设平衡时c(Ag+)=x,溶液中存在平衡:AgCl(s)![]() Ag+(aq)+Cl(aq),则Cl减少的浓度为3.5×103 mol·L1x,故平衡时c(Cl)=1.5×103 mol·L1+x,因而Ksp(AgCl)=c(Ag+)·c(Cl)=x·(1.5×103 mol·L1+x)=1.8×1010,因x值非常小,1.5×103 mol·L1+x≈1.5×103 mol·L1,解得x=1.2×107 mol·L1,说明Ag+沉淀完全。生成AgCl沉淀时,Cl是过量的,故析出AgCl的质量为m(AgCl)=3.5×103 mol·L1×60 L×143.5 g·mol1≈30.1 g。
Ag+(aq)+Cl(aq),则Cl减少的浓度为3.5×103 mol·L1x,故平衡时c(Cl)=1.5×103 mol·L1+x,因而Ksp(AgCl)=c(Ag+)·c(Cl)=x·(1.5×103 mol·L1+x)=1.8×1010,因x值非常小,1.5×103 mol·L1+x≈1.5×103 mol·L1,解得x=1.2×107 mol·L1,说明Ag+沉淀完全。生成AgCl沉淀时,Cl是过量的,故析出AgCl的质量为m(AgCl)=3.5×103 mol·L1×60 L×143.5 g·mol1≈30.1 g。
(3)AgCl溶液中存在下列平衡AgCl(s)![]() Ag+(aq)+Cl(aq),根据题意可知生成AgCl沉淀时Cl过量,相当于增大了Cl浓度,使得上述平衡逆向移动,故AgCl溶解度降低。
Ag+(aq)+Cl(aq),根据题意可知生成AgCl沉淀时Cl过量,相当于增大了Cl浓度,使得上述平衡逆向移动,故AgCl溶解度降低。


科目:高中地理 来源: 题型:
【题目】(1)写出下列反应的化学方程式,用双线桥法标明电子转移的方向和数目,并注明“被氧化”、“被还原”。
①Fe2O3与CO在高温下的反应:___________________________________。
②KClO3与MnO2在共热条件下反应:________________________________。
③H2S气体和SO2气体反应生成S和水:______________________________。
(2)写出下列反应的离子方程式,并用单线桥法标明电子转移的方向和数目。
①Cu和AgNO3溶液反应:________________________________________。
②实验室制Cl2的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:___________________________。
MnCl2+Cl2↑+2H2O:___________________________。
③向FeCl2溶液中通入Cl2生成FeCl3:____________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图所示,烧杯中的溶液为2 mol·L-1 CH3COOH溶液,接通直流电源。分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是
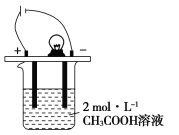
A.加入固体NaOH B.加水稀释
C.加入金属Na D.通入HCl气体
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2016北京]在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
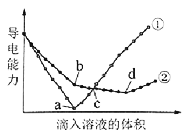
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】[2017江苏]常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.76×105,下列说法正确的是
A.浓度均为0.1 mol·L1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol·L1 HCOOH与0.1 mol·L1 NaOH 等体积混合后的溶液中:c(HCOO) + c(OH) = c(HCOOH) + c(H+)
D.0.2 mol·L1 CH3COONa 与 0.1 mol·L1盐酸等体积混合后的溶液中(pH<7):c(CH3COO) > c(Cl ) > c(CH3COOH) > c(H+)
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3、Pb(OH)42,各形态的浓度分数(α)随pH变化的关系如下图所示:
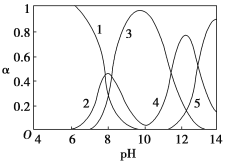
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3,5表示Pb(OH)42]
(1)Pb(NO3)2溶液中,![]() ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,![]() 增大,可能的原因是________________________________。
增大,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有______________,由pH=8到pH=9时主要反应的离子方程式为___________________________________。
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表;
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl |
处理前浓度/mg/L | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
处理后浓度/mg/L | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是____________________________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
A.3~4 B.6~7 C.8~9 D.10~12
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。
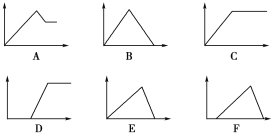
溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | |
②AlCl3溶液 | 通过量NH3 | |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(Ⅰ)从![]() 、
、![]() 、H+、Cu2+、Ba2+、Ag+、Cl等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
、H+、Cu2+、Ba2+、Ag+、Cl等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是_______________________________。
(2)若阴极析出金属,阳极放出O2,电解质的化学式可能是________________________________。
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是_______________________________。
(Ⅱ)已知反应:Cu+H2SO4(稀)===CuSO4+H2↑通常不能发生。请回答:
(4)试说明此反应在一般情况下不能反应的原因:_______________________________________。
(5)若向稀H2SO4溶液中通入热的空气,则发现铜会逐渐溶解。试写出有关的化学方程式:_______________________________________________________。
(6)根据你所学过的知识,设法使此反应能发生。具体的方法是_______________________________;反应原理是______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com