
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ____ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
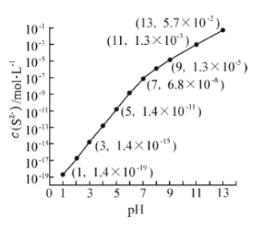
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
【答案】(15分)
(1)①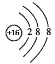 ;②C+2H2SO4(浓)
;②C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)①0.043;②5。
(3)①![]() ;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);③H2SO3+HCO3-=HSO3-+CO2↑+H2O。
;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);③H2SO3+HCO3-=HSO3-+CO2↑+H2O。
【解析】(1)①S是16号元素。S原子获得2个电子变为S2-,硫离子的结构示意图为![]() ②加热时,浓硫酸与木炭发生反应产生SO2、CO2和水,反应的化学方程式为C+2H2SO4(浓)
②加热时,浓硫酸与木炭发生反应产生SO2、CO2和水,反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑ +CO2↑+2H2O;①根据图像可知,在pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol·L-1H2S溶液中,根据S元素守恒可知:c(S2-)+ c(H2S)+c(HS-)=0.1 mol/L,而c(S2-)=5.7×10-2mol/L,因此c(H2S)+c(HS-)=0.1 mol/L -5.7×10-2 mol/L= 0.043 mol/L。②由于Ksp(MnS)=2.8×10-23,在某溶液c(Mn2+)=0.020 mol·L-1,则开始形成沉淀需要的S2-的浓度是c(S2-)= Ksp(MnS)÷c(Mn2+)=2.8×10-13÷0.020 mol/L=1.4×10-11 mol/L,根据图像中c(S2-)与溶液的pH关系可知,此时溶液pH=5,Mn2+开始形成沉淀。(3)①根据电离平衡常数的含义可知:HSO3-的电离平衡常数表达式是
2SO2↑ +CO2↑+2H2O;①根据图像可知,在pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol·L-1H2S溶液中,根据S元素守恒可知:c(S2-)+ c(H2S)+c(HS-)=0.1 mol/L,而c(S2-)=5.7×10-2mol/L,因此c(H2S)+c(HS-)=0.1 mol/L -5.7×10-2 mol/L= 0.043 mol/L。②由于Ksp(MnS)=2.8×10-23,在某溶液c(Mn2+)=0.020 mol·L-1,则开始形成沉淀需要的S2-的浓度是c(S2-)= Ksp(MnS)÷c(Mn2+)=2.8×10-13÷0.020 mol/L=1.4×10-11 mol/L,根据图像中c(S2-)与溶液的pH关系可知,此时溶液pH=5,Mn2+开始形成沉淀。(3)①根据电离平衡常数的含义可知:HSO3-的电离平衡常数表达式是![]() 。②盐Na2SO3在溶液中电离的方程式是:Na2SO3=2Na++SO32-,该盐是强碱弱酸盐,弱酸根离子SO32-发生水解反应:SO32-+H2O
。②盐Na2SO3在溶液中电离的方程式是:Na2SO3=2Na++SO32-,该盐是强碱弱酸盐,弱酸根离子SO32-发生水解反应:SO32-+H2O![]() HSO3-+OH-,水解产生的HSO3-又有部分发生水解反应:HSO3-+H2O
HSO3-+OH-,水解产生的HSO3-又有部分发生水解反应:HSO3-+H2O![]() H2SO3 +OH-,水解是逐步进行的,而且在溶液中还存在水的电离平衡,但是盐水解程度是微弱的,主要以盐电离产生的离子存在,所以0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。③由于多元弱酸分步电离,电离程度:一级电离>二级电离,电离程度越大,电离平衡常数就越大。所以根据表格数据可知H2SO3的二级电离平衡常数大于H2CO3的一级电离平衡常数,故H2SO3溶液和NaHCO3溶液反应的主要是复分解反应的规律:强酸与弱酸的盐发生反应制取弱酸。其离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O。
H2SO3 +OH-,水解是逐步进行的,而且在溶液中还存在水的电离平衡,但是盐水解程度是微弱的,主要以盐电离产生的离子存在,所以0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。③由于多元弱酸分步电离,电离程度:一级电离>二级电离,电离程度越大,电离平衡常数就越大。所以根据表格数据可知H2SO3的二级电离平衡常数大于H2CO3的一级电离平衡常数,故H2SO3溶液和NaHCO3溶液反应的主要是复分解反应的规律:强酸与弱酸的盐发生反应制取弱酸。其离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中地理 来源: 题型:
【题目】下列说法正确的是
A.金属氧化物一定是碱性氧化物
B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物
D.酸性氧化物一定是非金属氧化物
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为“2005-2013年江苏、新疆城镇人口比重变化图”。回答下列问题。
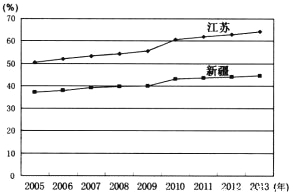
【1】与江苏相比,新疆的城市化
A.起步早,城市化水平低 B.起步早,城市发展速度快
C.发展速度慢,城市化水平低 D.发展速度快,城市化水平高
【2】影响两省区城市化进程差异的主要因素是
A.自然资源 B.人口数量
C.环境质量 D.经济发展水平
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】甲、乙两地人口抽样调查表(10000人中各年龄段人数及死亡的统计)
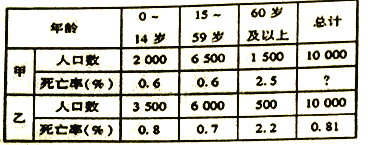
【1】甲组人口死亡率是( )
A. 0.775% B. 0.95% C. 3.7% D. 0.885%
【2】下列说法与表格内容相符的是( )
A. 甲组人口表示发展中国家,乙组人口表示发达国家
B. 各年龄段死亡率是甲组小于乙组,因此死亡总人口数也是甲组小于乙组
C. 所有发展中国家人口死亡率都高于发达国家
D. 甲组人口死亡率偏高一些,主要原因是甲组老年人口比例高
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_____________________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象___________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是___________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为水循环示意图,据图完成下列各题。
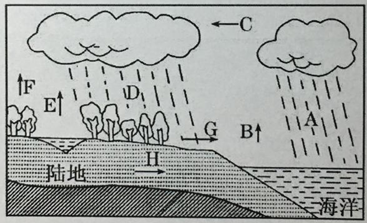
(1)图中字母表示的水循环环节,C是 ,F是 。
(2)我国西北地区的水循环类型主要为 。
(3)国家水利部集雨工程的实施,主要是对水循环的 环节施加影响,此项工程的好处是 。
(4)各水循环环节中,能够对H环节直接产生影响的环节是字母 。能够使H的储水量增大的条件有降水强度 ,降水历时 ,地面坡度 ,植被覆盖 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: ________________。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
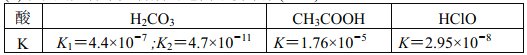
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是_______________;25℃时, 等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是___________________。
(3)常温下,将0.02 mol·L-1 的 Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为___________。
(4)25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比, _________(填化学式)溶液中的 c(Mg2+)大。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】水量盈余率是衡量水库蓄水量变化的重要指标(水量盈余率=流入量/流出量),图为某区域略图,表为图示水库各月水量盈余率统计表。据此回答下列各题。
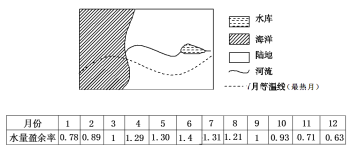
【1】根据图表信息判断,该地区位置及气候是( )
A.南半球、地中海气候
B.北半球、热带草原气候
C.南半球、热带草原气候
D.北半球、地中海气候
【2】关于图示水库的说法正确的是( )
A.12月份水库的储水量最大
B.3月份水库的储水量最大
C.6月份水库的储水量最小
D.9月份水库的储水量最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com