
【题目】利用实验室常用的物品,根据电化学原理,可以设计原电池。请填写下列空白:
(1)实验原理:Fe+2H+= 。
(2)实验用品:电极( 、 )(填所用电极的名称)、稀硫酸、烧杯、导线、耳机(或电流计)。
(3)实验装置如图所示。
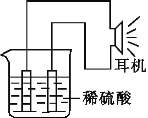
(4)原电池工作原理分析:
该原电池工作时,负极为 (填化学式),发生 (填“氧化”或“还原”),其电极反应式为 ,另一电极为正极,发生 反应,其电极反应式为 ,外电路中电子流动方向为 。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中地理 来源: 题型:
【题目】Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:![]()
方案二:![]()
(1)从节约药品的角度思考,你认为哪一种方案好?_____________,方案一和方案二共同存在的问题是___________________
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(双选题)关于硫的叙述正确的是( )
A.硫的非金属性较强,所以只以化合态存在于自然界
B.分离黑火药中的硝酸钾、炭、硫要用到二硫化碳、水以及过滤操作
C.硫与金属或非金属反应均作为氧化剂
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化物
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )。

A.Y原子的电子总数是其K层电子数的3倍
B.原子半径大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q)
C.Q的单质能与W的氢化物发生置换反应
D.元素W的最高价氧化物对应水化物的酸性比Q的强
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】电石中的CaC2与H2O反应可用于制C2H2:CaC2+2H2O→C2H2↑+Ca(OH)2。通过排水测量出反应产生的气体的体积,从而可测定电石中碳化钙的含量。
(1)若使用下列仪器和导管组装实验装置,如下所示:
仪器和 导管 |
|
|
|
仪器和 导管 |
|
|
|
每个橡皮塞都打了两个孔 | |||
如果所制气体从左向右通过时,上述仪器和导管从左到右直接连接的顺序是(填仪器与导管的序号):
________接________接________接________接________接________。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是(用操作编号填空)________。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有________杂质。
(4)若实验时称取电石为1.60 g,测量出排水的体积后,折算成标准状况下乙炔的体积为448 mL,求此电石中碳化钙的质量分数。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】将蔗糖溶于水配成10%的溶液,分装在两支试管中。分别进行如下实验:
(1)在第一支试管中加入新制Cu(OH)2悬浊液并加热,没有红色沉淀产生,原因是_______________________;
(2)在第二个试管中加入几滴稀硫酸,再放在水浴中加热,再加入足量NaOH并加入新制Cu(OH)2悬浊液,加热。
①现象是__________________________;
②原因是__________________________;
③加入足量NaOH的作用是________________________;
④上述实验中发生的化学方程式是__________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】描述下列反应的现象并写出反应的离子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,现象:__________________,离子方程式:__________________________。
(2)向NaHCO3溶液中滴加稀H2SO4,现象:__________________,离子方程式:________________________。
(3)稀HNO3和Ba(OH)2溶液混合,现象:__________________,离子方程式:_____________________________。
(4)比较:上述三个离子反应发生的条件的不同点是______________________;相同点是_______________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com