
【题目】有A、B、C、D四种无色溶液,它们分别是一定浓度的AlCl3溶液、盐酸、氨水、Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。请回答下列问题:
(1)A是_______,B是_______,C是_______,D是_______。
(2)写出足量B溶液与少量C溶液混合后发生反应的离子方程式:_____________________________。
(3)A、B溶液等体积混合后,溶液中各离子浓度由大到小的顺序是:________________。
【答案】(1)盐酸 氨水 AlCl3溶液 Na2SO4溶液
(2)Al3++3NH3·H2O===Al(OH)3↓+3![]()
(3)c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
【解析】四种溶液中,AlCl3能促进水的电离,盐酸、氨水能抑制水的电离,Na2SO4对水的电离没有影响,根据“A、B溶液中水的电离程度相同”可知A、B一定是盐酸、氨水;AlCl3溶液、盐酸都呈酸性,氨水呈碱性,Na2SO4溶液呈中性;根据“A、C溶液的pH相同”可判断A一定是盐酸、C一定是AlCl3溶液。
(1)综合上述判断可知A是盐酸,B是氨水,C是AlCl3溶液,D是Na2SO4溶液。
(2)足量氨水与少量AlCl3溶液发生反应生成Al(OH)3沉淀,离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3![]() 。
。
(3)HCl是强电解质,完全电离,NH3·H2O是弱电解质,部分电离,盐酸与氨水中水的电离程度相同,则氨水的浓度远大于盐酸的浓度,则等体积混合后,氨水过量,溶质为NH4Cl和NH3·H2O,溶液中各离子浓度由大到小的顺序是c(![]() )>c(Cl-)>c(OH-)>c(H+)。
)>c(Cl-)>c(OH-)>c(H+)。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中地理 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。
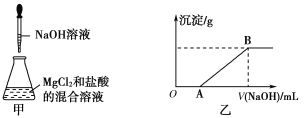
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如下图所示的甲、乙、丙三种晶体:
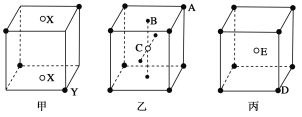
试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:__________________,理由:_________________________________。
②熔融状态下的NaCl:__________________,理由:_________________________________。
③高温熔化后的单质铁:__________________,理由:_________________________________。
④固体KOH:__________________,理由:________________________________。
(2)写出下列物质在水溶液中的电离方程式。
HCl:__________________________________________________________________;
H2SO4:________________________________________________________________;
Ca(OH)2:______________________________________________________________;
KOH:________________________________________________________________;
NH4NO3:_____________________________________________________________;
KAl(SO4)2:____________________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
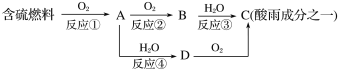
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中![]() 和
和![]() 浓度的比值c(
浓度的比值c(![]() )∶c(
)∶c(![]() )=________。
)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com