
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
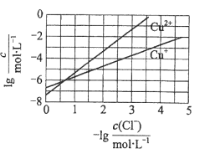
A.![]() 的数量级为
的数量级为![]()
B.除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]()
![]() 2CuCl
2CuCl
C.加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D.2Cu+![]() Cu2++Cu平衡常数很大,反应趋于完全
Cu2++Cu平衡常数很大,反应趋于完全
科目:高中地理 来源: 题型:
【题目】实验证实基因位于染色体上的科学家和揭示出DNA分子是双螺旋结构的科学家分别是( )
A.孟德尔、摩尔根
B.萨顿、沃森和克里克
C.萨顿、艾弗里
D.摩尔根、沃森和克里克
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Where does the conversation most probably take place?
A. In a cinema. B.At an airport. C.At a hotel.
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】黄河孕育了灿烂的中华文明,但其身体上也存在许多“病症”。读下图回答下面小题。
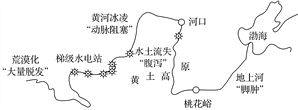
【1】有关黄河各河段“病症”的主要成因及“药方”对应正确的是(双选)( )
A. “大量脱发”——气候寒冷干燥——修筑梯田
B. “动脉阻塞”——过度放牧与垦殖——建立自然保护区
C. “腹泻”——地表植被破坏——退耕还林、还草
D. “脚肿”——泥沙淤积——疏浚河道、加固堤坝
【2】有关黄河流域开发整治的正确方向是(双选)( )
A. 全流域综合考虑,协调发展
B. 采用珠江流域上、中、下游的开发措施
C. 不同河段的工农业发展方向一致
D. 要考虑流域的整体性特征
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下面左图为1999~2007年我国耕地减少的重心转移示意图,右图为1999~2007年我国耕地面积与粮食产量变化曲线图。读图完成下列问题。
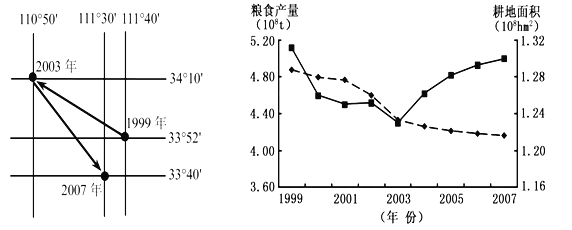
【1】1999~2003年,我国耕地减少的重心转移的主要原因是( )
A.东南沿海地区城市化速度快 B.东南沿海地区种植业结构调整
C.西部大开发 D.西北地区合理开发耕地后备资源
【2】2003~2007年,我国粮食产量变化的主要原因是( )
A.资金、科技投入加大 B.交通条件不断改善
C.农业劳动力增加 D.经济作物种植面积扩大
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某兴趣小组进行下列实验:①将0.1 mol·L1 MgCl2溶液和0.5 mol·L1 NaOH溶液等体积混合得到溶液;
②取少量①中浊液,滴加0.1 mol·L1FeCl3溶液,出现红褐色沉淀;
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L1 FeCl3溶液,白色沉淀变为红褐色沉淀;
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中不正确的是
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH(aq)
Mg2+(aq)+2OH(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的![]() 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】阅读图文资料,完成下列问题。
材料一:
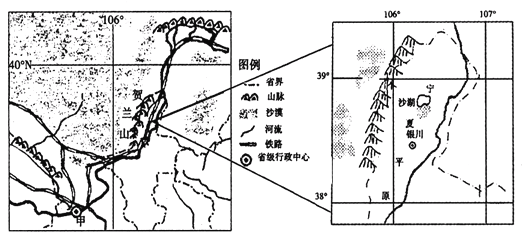
材料二:
贺兰山东麓昼夜温差大,阳光充足,地理条件得天独厚。近年来,大力发展食用葡萄和酿酒葡萄。并建设多个葡萄酒庄,自主繁育了多种优质葡萄品种。
(1)该地有利于葡萄种植的区位优势是 。
(2)决定该地葡萄酒业兴起最主要的一组区位因素是 。(单项选择填空)
A.原料、劳动力 B.原料、市场
C.能源、市场 D.交通、能源
(3)葡萄产业发展对该地社会经济的积极影响有 、 等。
(4)贺兰山被称为银川平原的“守护神”,分析其原因。
(5)近年来,沙湖的知名度不断提高,试分析其对当地社会经济和生态环境的影响。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核矿中制取纯净的MnO2的工艺流程如图所示:
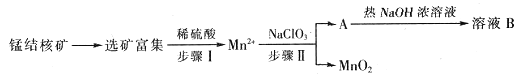
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 1017 | 1017 | 1039 |
已知:一定条件下,![]() 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
(1)步骤Ⅱ中消耗0.5 mol Mn2+时,用去1 mol·L1的NaClO3溶液200 mL,该反应离子方程式为__________________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是_____________。
(3)MnO2是碱性锌锰电池的正极材料。放电过程产生MnOOH,该电池正极的电极反应式为_________________。如果维持电流强度为5 A,电池工作五分钟,理论消耗锌_________________g。(精确到0.1,已知F=96500 C/mol)
(4)向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式:_____________________。向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2。_________________________________。
(5)用废电池的锌皮制作ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为________(精确到0.1)时,铁刚好沉淀完全(离子浓度小于1×105 mol·L1时,即可认为该离子沉淀完全)。继续加碱调节pH为__________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com