
【题目】按下图所示装置进行实验,并回答下列问题:
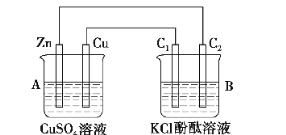
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为__________极,电极反应式为____________________________________________;
铜极为__________极,电极反应式为_____________________________________________;
石墨棒C1为__极,电极反应式为________;石墨棒C2附近发生的实验现象为
________________________________________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)________g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
【答案】(1)原电池 电解池
(2)负 Zn2e===Zn2+ 正 Cu2++2e===Cu
阳 2Cl2e===Cl2↑ 有无色气体产生,附近溶液出现红色
(3)减少 0.65 增加 0.01
【解析】(1)A池中Zn、Cu放入CuSO4溶液中构成原电池,B池中两个电极均为石墨电极,在以A为电源的情况下构成电解池,即A原电池带动B电解池。
(2)A池中Zn为负极,Cu为正极,B池中C1为阳极,C2为阴极,阴极区析出H2,周围OH富集,酚酞变红。
(3)n(H2)=0.224 L÷22.4 L·mol1=0.01 mol,故电路中转移电子的物质的量为0.01 mol×2=0.02 mol,根据得失电子守恒,锌极有0.01 mol Zn溶解,即Zn极质量减少0.01 mol×65 g·mol1=0.65 g,铜极上有0.01 mol Cu析出,即CuSO4溶液增加了0.01 mol×(65 g·mol164 g·mol1)=0.01 g。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中地理 来源: 题型:
【题目】“碘钟”实验中,3I-+![]() ===
===![]() +2
+2![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-1)/(mol·L-1) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是__________________________________。
(2)上表中显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3、Pb(OH)42,各形态的浓度分数(α)随pH变化的关系如下图所示:
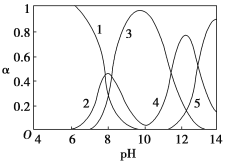
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3,5表示Pb(OH)42]
(1)Pb(NO3)2溶液中,![]() ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,![]() 增大,可能的原因是________________________________。
增大,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有______________,由pH=8到pH=9时主要反应的离子方程式为___________________________________。
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表;
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl |
处理前浓度/mg/L | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
处理后浓度/mg/L | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是____________________________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
A.3~4 B.6~7 C.8~9 D.10~12
查看答案和解析>>
科目:高中地理 来源: 题型:
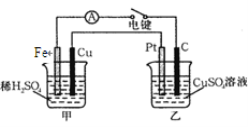
【题目】原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________。
(2)下列反应能设计成原电池的是: 。
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)下图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(Ⅰ)从![]() 、
、![]() 、H+、Cu2+、Ba2+、Ag+、Cl等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
、H+、Cu2+、Ba2+、Ag+、Cl等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是_______________________________。
(2)若阴极析出金属,阳极放出O2,电解质的化学式可能是________________________________。
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是_______________________________。
(Ⅱ)已知反应:Cu+H2SO4(稀)===CuSO4+H2↑通常不能发生。请回答:
(4)试说明此反应在一般情况下不能反应的原因:_______________________________________。
(5)若向稀H2SO4溶液中通入热的空气,则发现铜会逐渐溶解。试写出有关的化学方程式:_______________________________________________________。
(6)根据你所学过的知识,设法使此反应能发生。具体的方法是_______________________________;反应原理是______________________________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)实验室制取Cl2时,下列操作不正确的是________(填序号)。

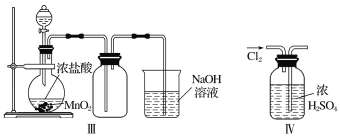
①装置Ⅰ可用于制取少量Cl2
②用装置Ⅱ除去Cl2中的少量HCl
③用装置Ⅲ制取Cl2
④用装置Ⅳ干燥Cl2
(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂有__________、__________、__________。
(3)已知KMnO4与浓盐酸在常温下反应能产生Cl2。
若用如下图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是________(填字母,下同)。
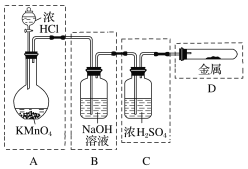
(4)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的装置正确的是________。
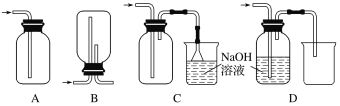
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Not until all the fish died in the river how serious the pollution was.
A. did the villagers realize
B. the villagers realized
C. the villagers did realize
D. didn’t the villagers realize
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜(2NH3+3CuO![]() N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
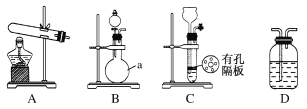
甲小组测得,反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状况下的体积V1 L。乙小组测得,洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:________。
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、 硫酸、硫酸铵 | 反应的化学方程式为①____________________ |
乙小组 | ②______ | 浓氨水、氢氧化钠 | 氢氧化钠溶于氨水后放热,增加氢氧根离子浓度,加快氨气逸出 |
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为________。
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是__________________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如图变化关系:
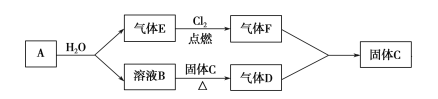
(1)A的名称是______________;F的化学式是______________。
(2)B→D反应的化学方程式为________________________。
(3)F+D→C反应的化学方程式为__________________________。
(4)F在空气中遇水蒸气产生白雾现象,这白雾实际上是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com