
【题目】(1)元素周期表体现了元素周期律,即元素的性质随着_________的递增呈现___________的变化。
(2)元素周期表前四周期元素中失电子能力最强的元素是___________(填元素符号,下同),得电子能力最强的元素是___________。
(3)短周期元素X、Y、Z在周期表中的位置关系如图所示,则
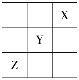
①Y、Z元素的气态氢化物的稳定性__________>__________(填化学式)。
②三种元素形成的单质中熔点最高的是___________(填化学式)。
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中地理 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示;
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
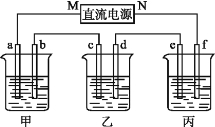

上图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间(t)的关系图如上。据此回答下列问题;
(1)M为电源的 (填“正”或“负”)极,电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 。
(3)写出乙烧杯的电解总反应; 。
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)要使丙恢复到原来的状态,操作是 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)浓硫酸与木炭在加热条件下反应的化学方程式为________。
(2)试用下表所列各装置设计一个实验,验证上述反应的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是________→________→________→________(填装置的编号)
编号 | 装置 |
① |
|
② |
|
③ |
|
④ |
|
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是___________,B瓶溶液的作用是___________,C瓶溶液的作用是___________。
(4)装置②中所加的固体药品是________,可验证的产物是_______,确定装置②在整套装置中位置的理由是___________。
(5)装置③中所盛的溶液是__________,可验证的产物是_____________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某元素的氯化物化学式为MCl2,现将11.1 g该氯化物溶于水配成溶液后,需用200 mL 1 mol·L-1 AgNO3溶液才能把溶液中氯离子完全沉淀。已知该M原子中有20个中子,则:
(1)计算M的质量数并写出其原子组成符号。
(2)指出M元素在周期表中的位置(周期、族)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)
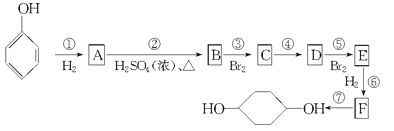
(1)写出有关物质的结构简式:
A_______________;
C_______________。
(2)指出反应类型:
C→D:___________________________;
F→G:___________________________;
(3)写出下列反应的化学方程式:
D+E→F:_________________________;
F→G:____________________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(1)相邻的两个或多个原子之间 ,叫作化学键。通常,主族元素中活泼的 和活泼的 相互化合时分别失去和得到电子,形成具有稀有气体元素原子结构的 离子和 离子。这些离子之间除了有相互吸引的作用外,还有 和 、 和 之间的相互排斥作用。当两种离子之间接近到一定距离时, 和 作用达到了平衡,于是就形成了稳定的化学键。这种由 间通过 所形成的化学键叫作离子键。
(2)写出下列物质的电子式:
①氟化钙 ;
②溴化钾 ;
③硫化钠 ;
④氧化钙 。
(3)用电子式表示下列离子化合物的形成过程:
①氧化钠 。
②氯化镁 。
③硫化钠 。
④氯化铷 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】如图是某同学利用注射器设计的简易实验装置。甲管中吸入10 mL CH4,同温同压下乙管中吸入50 mL Cl2,将乙管气体推入甲管中,将注射器用日光照射一段时间。
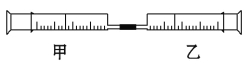
(1)下列是某同学预测的实验现象:
①气体最终变为无色;
②实验过程中,甲管活塞向内移动;
③甲管内壁有油珠;
④产生火花。
其中正确的是 。
(2)甲管中发生的化学反应类型为 。
(3)反应后,甲管中剩余气体最好用下列的 吸收。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到 ,若用pH试纸测量甲管中溶液的酸碱性,可观察到pH试纸变 色。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
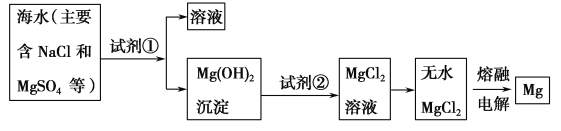
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是__________________。
(3)试剂②选用________;写出其反应的离子方程式____________________________。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为______________________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的______作氧化剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com