
科目: 来源: 题型:
【题目】已知在相同条件下电离常数有如下关系:Ka1(H2CO3)>Ka(HBrO)>Ka2(H2CO3)。下列离子方程式或化学方程式中不正确的是
A.向NaHCO3溶液中滴加少量溴水:![]() +Br2
+Br2![]() HBrO+Br+CO2↑
HBrO+Br+CO2↑
B.向Na2CO3溶液中滴加少量溴水:2![]() +Br2+H2O
+Br2+H2O![]() BrO-+Br-+2
BrO-+Br-+2![]()
C.向NaBrO溶液中通入少量的CO2:CO2+NaBrO+H2O![]() NaHCO3+HBrO
NaHCO3+HBrO
D.向NaBrO溶液中通入足量的CO2:CO2+2NaBrO+H2O![]() Na2CO3+2HBrO
Na2CO3+2HBrO
查看答案和解析>>
科目: 来源: 题型:
【题目】在a、b两支试管中分别装入形态相同、质量相等的一颗锌粒,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:相同点是__________,不同点是________________,原因是______________________________________。
(2)a、b两支试管中生成气体的体积开始时是V(a)___V(b),反应完毕后生成气体的总体积是V(a)________V(b),原因是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时某些弱酸的电离平衡常数如表。
CH3COOH | HClO | H2CO3 |
Ka=1.75×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下面图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。
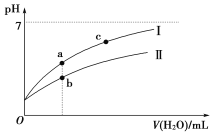
(1)相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是____________________。
(2)向NaClO溶液中通入少量二氧化碳的离子方程式为______________。
(3)图像中a、c两点处的溶液中![]() ________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
(4)图像中a点酸的总浓度________(填“大于”“小于”或“等于”)b点酸的总浓度。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是几种常见弱酸的电离平衡常数(25 ℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.75×10-5 |
H2CO3 | H2CO3
| K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-12 |
H3PO4 | H3PO4
| K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列各题:(1)当温度升高时,K值________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?________________________________。
(3)若把CH3COOH、H2CO3、![]() 、H2S、HS-、H3PO4、
、H2S、HS-、H3PO4、![]() 、
、![]() 都看作是酸,其中酸性最强的是________,最弱的是________。
都看作是酸,其中酸性最强的是________,最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_________________,产生此规律的原因是_____________________________。
(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实________(填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。
方案:______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:![]() +4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
+4H++3e―→NO↑+2H2O。在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
①写出并配平该氧化还原反应的化学方程式:______________________。
②上述反应中被还原的元素是________,还原剂是________。
③反应生成0.3 mol H2O,则转移电子的数目为________mol。
(2)请配平下面化学方程式。
____CH3CH2OH+____KMnO4―→____CH3CHO+____MnO2+____KOH+____H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】在课堂上,老师演示了金属钠与CuSO4溶液的反应,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现铜单质生成。但某同学想:会不会因生成的铜较少被蓝色沉淀所覆盖而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
假如该同学是你,请你写一张实验准备单交给老师,请求老师提供必需的用品。
(1)实验探究的目的是______________________。
(2)探究所依据的化学原理是________________(用必要的文字和化学方程式表示)。
(3)实验必需仪器:小刀、玻璃片、滤纸、____和____;实验药品:金属钠、____和____。该同学在探究实验中意外地发现生成的蓝色沉淀中混有少量的黑色难溶物,而所使用的药品均没有问题,你认为该黑色难溶物是____________,生成该黑色难溶物的原因是________________________________
(用必要的文字和化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学平衡移动原理同样也适用于其他平衡。已知在氨水中存在下列平衡:
NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度 (填“增大”“减小”或“不变”,下同),![]() 的浓度 。
的浓度 。
(2)向氨水中加入浓盐酸,平衡向 移动,此时溶液中浓度减小的粒子有 、 、 。
(3)向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】和下列离子反应方程式相对应的化学方程式正确的是
A.Cu2++2OH===Cu(OH)2——CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.Ba2++![]() ===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
===BaSO4↓——Ba(OH)2+H2SO4===BaSO4↓+2H2O
C.Ag++Cl===AgCl↓——AgNO3+NaCl===AgCl↓+NaNO3
D.Cu+2Ag+===Cu2++2Ag↓——Cu+2AgCl===2Ag+CuCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一定温度时时有关弱酸的电离平衡常数如下表:
弱酸化学式 | HX | HY | H2CO3 |
电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
该温度下,下列推断正确的是
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:![]() >Y->X->
>Y->X->![]()
D.HX和HY酸性相同,都比H2CO3弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com