
科目: 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系,回答下列问题。
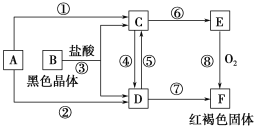
(1)确定A、B、C、D、E、F的化学式, A为________,B为________,C为________,D为________,E为________ ,F为________。
(2)写出反应⑧的化学方程式和反应④、⑤的离子方程式。
⑧____________________________________________________________;
④_____________________________________________________________;
⑤_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1.为探究从镀银车间的废液中回收银的效果,某化学兴趣小组的同学在25 ℃时进行了下列分析:
(1)他们取了35 L Ag+浓度为6×103 mol·L1的某镀银车间回收液,然后加入0.012 mol·L1NaCl溶液25 L,此时 (填“能”或“不能”)观察到AgCl沉淀。
(2)最后该溶液中的c(Ag+)为 ,生成AgCl的质量为 。
(3)AgCl在上述溶液中的溶解度与在纯水中的相比, 中的溶解度较大。
[已知Ksp(AgCl)=1.8×1010]
查看答案和解析>>
科目: 来源: 题型:
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的化学方程式(离子反应需写离子方程式):
(1)Fe2O3(Al2O3)_________________________________________________;
方程式________________________________________________________。
(2)Fe2O3[Fe(OH)3]______________________________________________;
方程式_________________________________________________________。
(3)FeSO4溶液(CuSO4)___________________________________________ __;
方程式__________________________________________________________。
(4)FeCl3溶液(FeCl2)________________________________________________;
方程式________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×1010,Ksp(AgY)=1.0×1012,Ksp(AgZ)=8.7×1017;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为:_________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为______________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:_____________。
②在上述(3)的体系中,能否实现AgY向AgX的转化?
下面根据你的观点选答一项。
若不能,请简述理由:___________________________________。
若能,则实现转化的必要条件是:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为:________________________________。
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是_________________________________。
(4)检验Fe3+存在的最佳试剂是____________,现象是______________________________________。
(5)写出Fe与H2O(g)在一定条件下反应的化学方程式:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
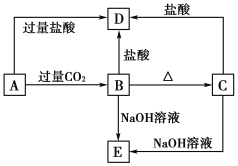
请回答下列问题:
(1)写出化学式:A__________,B__________,C__________,D__________,E__________。
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[2017江苏]常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.76×105,下列说法正确的是
A.浓度均为0.1 mol·L1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol·L1 HCOOH与0.1 mol·L1 NaOH 等体积混合后的溶液中:c(HCOO) + c(OH) = c(HCOOH) + c(H+)
D.0.2 mol·L1 CH3COONa 与 0.1 mol·L1盐酸等体积混合后的溶液中(pH<7):c(CH3COO) > c(Cl ) > c(CH3COOH) > c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】[2016新课标Ⅰ]298 K时,在20.0 mL 0.10 mol![]() 氨水中滴入0.10 mol
氨水中滴入0.10 mol![]() 的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol![]() 氨水的电离度为1.32%,下列有关叙述正确的是
氨水的电离度为1.32%,下列有关叙述正确的是
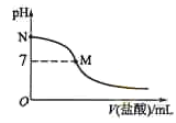
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl)=c(H+)=c(OH)
D.N点处的溶液中pH<12
查看答案和解析>>
科目: 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
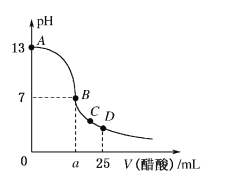
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列有关表述中正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有![]() 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+ c(H2CO3)= c(OH-)
C.10 mL 0.10 mol/L CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com