
科目: 来源: 题型:
【题目】下列反应中,既是化合反应又是氧化还原反应的是
A.二氧化硫催化氧化成三氧化硫:2SO2+O2![]() 2SO3
2SO3
B.氯气通入溴化钠溶液中:Cl2+2NaBr![]() 2NaCl+Br2
2NaCl+Br2
C.稀盐酸与硝酸银溶液混合反应:HCl+AgNO3![]() AgCl↓+HNO3
AgCl↓+HNO3
D.氧化钠跟水反应:Na2O+H2O![]() 2NaOH
2NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如图所示:
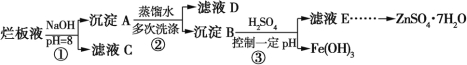
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成偏锌酸钠。Zn(OH)2溶解的离子方程式为 。
(3)滤液D中除了含有OH外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2 mol·L1,c(Fe3+)=2.6×109mol·L1,能求得的溶度积是 。
A.Ksp [Zn(OH)2] B.Ksp [Zn(OH)2]和Ksp [Fe(OH)3] C.Ksp [Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是 。
(6)已知:①Fe(OH)3(s)![]() Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
Fe3+(aq)+3OH(aq) ΔH=a kJ·mol1
②H2O(l)![]() H+(aq)+OH(aq) ΔH=b kJ·mol1
H+(aq)+OH(aq) ΔH=b kJ·mol1
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K= (用含Ksp、Kw的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有如图所示物质的相互转化:
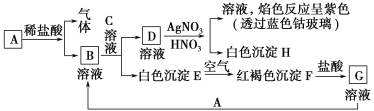
试填写下列空白:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式_______________________________。
(3)写出下列反应的离子方程式:
D溶液与AgNO3溶液反应:________________________________________;
向G溶液中加入A:_____________________________________________。
(4)A与稀盐酸反应生成0.1 mol气体,转移电子数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示人体细胞与外界环境之间进行物质交换的过程。A、B、C、D表示四种体液,①②表示有关的物质。请据图回答:

(1)A~D中不属于内环境成分的是[ ] ;[ ] 是体内绝大多数细胞直接生活的环境。
(2)B体液是 ,经过循环它由 汇入C中。B、C的成分相近,两者最主要的差别是 。
(3)C的渗透压大小主要与 的含量有关;其酸碱度保持相对稳定,与它含有的 、HPO42-等离子有关。
(4)如果②代表O2,由体外进入到组织细胞需要 (系统)协助完成;机体维持稳态的主要调节机制是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所示是几种弱电解质的电离平衡常数和某难溶电解质的溶度积Ksp(25 ℃)。
电解质 | 平衡方程式 | 电离平衡常数 | Ksp |
CH3COOH | CH3COOH | 1.76×105 | |
H2CO3 | H2CO3 HC | Ka1=4.31×107 Ka2=5.61×1011 | |
C6H5OH | C6H5OH | 1.1×1010 | |
H3PO4 | H3PO4
| Ka1=7.52×103 Ka2=6.23×108 Ka3=2.20×1013 | |
NH3·H2O | NH3·H2O | 1.76×105 | |
BaSO4 | BaSO4(s) | 1.07×1010 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②![]() ,③C6H5OH,④
,③C6H5OH,④![]() 均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
(2)25 ℃时,将等体积、等浓度的CH3COOH溶液和氨水混合,混合液中:c(CH3COO) (填“>”“=”或“<”)c(![]() )。
)。
(3)25 ℃时,向10 mL 0.01 mol·L1苯酚溶液中滴加V mL 0.01 mol·L1氨水,下列说法正确的是 (填序号)。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(![]() )>c(C6H5O)>c(H+)>c(OH)
)>c(C6H5O)>c(H+)>c(OH)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 mol·L1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(![]() )=c(C6H5O)+c(C6H5OH)
)=c(C6H5O)+c(C6H5OH)
(4)如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是 (填序号)。
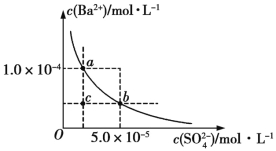
A.加入Na2SO4可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钠与水的反应是中学化学中的一个重要反应。教材中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
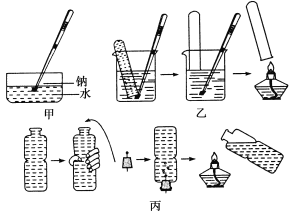
(1)现按图甲所示的方法,在室温时,向盛有饱和Ca(OH)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.溶液底部有银白色物质生成
D.恢复到室温时,水槽底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→__________________→用镊子夹取切好的金属钠投入到盛有Ca(OH)2溶液的水槽中。
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功。正确的操作应为________________________________________________。
(4)用装满水的矿泉水瓶按图丙方法进行实验。用手挤压矿泉水瓶并塞紧带有钠的塞子。共排出水的体积为16.8 mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均属于标准状况,则所用的钠的质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3、Pb(OH)42,各形态的浓度分数(α)随pH变化的关系如下图所示:
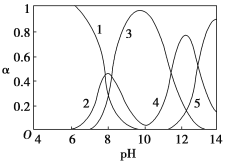
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3,5表示Pb(OH)42]
(1)Pb(NO3)2溶液中,![]() ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,![]() 增大,可能的原因是________________________________。
增大,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有______________,由pH=8到pH=9时主要反应的离子方程式为___________________________________。
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表;
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl |
处理前浓度/mg/L | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
处理后浓度/mg/L | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是____________________________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
E2Pb(s)+2H+,则脱铅的最合适pH范围为________(填编号)。
A.3~4 B.6~7 C.8~9 D.10~12
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y |
|
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为__________________________。
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3,还含有的离子有_________________。
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为_______________。沉淀转化的主要原因是______________。
(4)已知:Ag+ + 2NH3· H2O ![]() Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
(5)结合上述信息分析,下列预测不正确的是 。
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读材料,回答下列问题。
材料:近年来,科技人员研究得到一种新型材料——泡沫铝,它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是________。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔作食品包装,是利用它的哪一性质________。
A.金属光泽 B.延展性
C.导电性 D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:
与盐酸反应的离子方程式:__________________________________________。
与氢氧化钠溶液反应的离子方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①②③④分别是
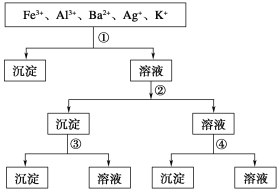
A.①NaCl、②NaOH、③NH3·H2O、④H2SO4
B.①H2SO4、②NaOH、③NH3·H2O、④NaCl
C.①H2SO4、②NH3·H2O、③NaOH、④NaCl
D.①NaCl、②NH3·H2O、③NaOH、④H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com