
科目: 来源: 题型:
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关问题:
(1)写出D元素价电子的电子排布式___________。
(2)D可形成化合物[D(H2O)6](NO3)3。
①[D(H2O)6](NO3)3中阴离子的立体构型是_________。![]() 中心原子的轨道杂化类型为 。
中心原子的轨道杂化类型为 。
②在[D(H2O)6]3+中D3+与H2O之间形成的化学键称为_________,1 mol [D(H2O)6] 3+中含有的σ键有 mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子。另一种物质的电子式为 。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个A+最近的C有______个,这些C围成的图形是________;若晶体密度为ρ g·cm3,阿伏加德罗常数的值用NA表示,则A+的离子半径为_______cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Furthermore,students have to pay postage to send letters,something the students might be___
A.unwilling to
B.unwilling to do
C.unwilling to be done
D.unwillingly
查看答案和解析>>
科目: 来源: 题型:
【题目】The people present all make it clear that determination is the___of his constant success
A.reason
B.fact
C.cause
D.truth
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年4月,全国“海绵城市”建设试点工作启动。“海绵城市”是指城市像海绵一样具有“弹性”,在适当环境变化和减轻自然灾害等方面具有一定的功能,读海绵城市示意图,回答下列各题。
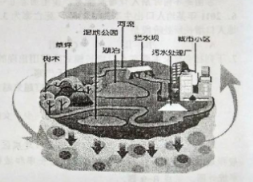
【1】海绵城市中的
A.树木、草坪可大量吸收降水和地下水
B.湿地公园、污水处理厂可以净化水质
C.河流、湖泊可调节多雨期和少雨期的降水量
D.城市小区、拦水坝可以增加下渗水量
【2】城市小区建设采取屋顶绿化、下凹式绿地、透水铺地等措施,主要作用是
A.增强雨水的滞留和下渗
B.削弱雨水对建筑物的冲刷
C.增加生物种类的多样性
D.保证小区生活和绿化用水
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G(![]() )是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
)是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

(1)A与银氨溶液反应有银镜生成,则A的结构简式是____________,D中官能团名称为_________________B→C的反应类型是________反应。
(2)下列关于G的说法不正确的是__________(填字母)。
A.能与溴的四氯化碳溶液反应 b.能与金属钠反应
C.1molG最多能和5mol氢气反应 d.分子式是C9H6O3
(3)写出一种满足下列条件的E的同分异构体的结构简式:___________________。
①苯环上的一氯取代产物只有两种;
②能发生银镜反应;
③能与FeCl3溶液发生显色反应。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:_____________。
(5)请设计合理的方案以苯酚和乙醇为原料合成乙酸苯酯(![]() )(用合成路线流程图表示,并注明反应条件)。提示:①合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:A
)(用合成路线流程图表示,并注明反应条件)。提示:①合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:A![]() B
B![]() C……→D。
C……→D。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A.甲醇、乙二醇、丙三醇都易溶于水且都有剧毒
B.按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高
C.相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多
D.甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4![]() 2KCl+2CrO2Cl2+3COCl2↑。
2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690 pm和780 pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
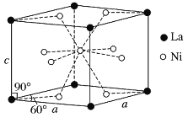
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol1,密度为d g·cm3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×105 g·cm3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】读工业区位选择模式示意图,回答下列问题。
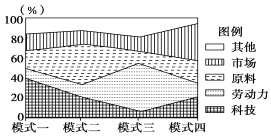
【1】下列工业部门与工业模式二对应的是
A.时装设计 B.炼铝厂 C.电视机装配 D.水果罐头厂
【2】关于工业模式三的叙述,正确的是
A.产品运输成本较高,布局宜靠近市场
B.因大气污染严重,宜布局在郊外
C.目前该产业在我国由沿海向内陆转移
D.该模式的工业在布局时受科技影响较大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关显微镜使用的相关叙述中,正确的是 ( )
A.目镜放大倍数与镜身长短成正比,而物镜的放大倍数与镜身长短成反比
B.在不调换物镜的情况下也能准确判断视野中异物所在位置
C.物镜放大倍数越小,镜头越长,观察时,物镜与标本的距离越短
D.用高倍镜观察标本时,要使物像更清晰,需调节粗准焦螺旋
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com