
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 先判断该分子符合哪类烃的通式,再根据题意判断含有的官能团,再判断其同分异构体.
解答 解:该烃的分子式符合CnH(2n-6)的通式,它不能使溴水褪色,但可使KMnO4酸性溶液褪色,所以含有苯环;根据题意知,该分子含有丁烷烷基,所以只判断丁烷烷基的同分异构体即可;丁烷烷基的碳链同分异构体有: ,苯的同系物中与苯环相连的C原子上必须含有H原子,才可被酸性高锰酸钾氧化,使酸性高锰酸钾溶液褪色,烷基
,苯的同系物中与苯环相连的C原子上必须含有H原子,才可被酸性高锰酸钾氧化,使酸性高锰酸钾溶液褪色,烷基 ,与苯环相连的C原子上不含H原子,不能使酸性高锰酸钾溶液褪色,所以此烃的结构共有3种;故选B.
,与苯环相连的C原子上不含H原子,不能使酸性高锰酸钾溶液褪色,所以此烃的结构共有3种;故选B.
点评 本题考查了同分异构体的书写,难度不大,侧重考查学生思考问题的全面性,书写同分异构体时注意不能漏写、重写.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2是还原剂,PbCl2是氧化剂 | B. | CuCl2是还原剂,O2是氧化剂 | ||
| C. | 乙烯是还原剂,O2是氧化剂 | D. | PbCl2和CuCl2都是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
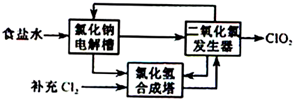
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
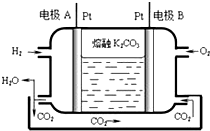 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com