
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,易溶于乙醇和丙醇等有机溶剂。
Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)![]() CH3Cl+H2O。
CH3Cl+H2O。
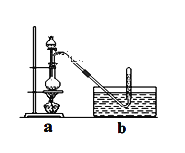
具体步骤如下:①干燥ZnCl2晶体;②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是________________;
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是__________;
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化,现有四只洗气瓶分别盛有以下试剂:A.1.5%KMnO4(H+)溶液;B.蒸馏水;C.5%Na2SO3溶液;D.98%H2SO4。
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶____(填洗气瓶编号),如果观察到_________则证实上述资料的正确性。
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):______;
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛______的洗气瓶。
【答案】在干燥的HCl气流中加热 增大盐酸的量以提高甲醇的转化率 BAC 紫色褪去 10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+2H+ 乙醇或丙醇
【解析】
Ⅰ.(1)因ZnCl2晶体直接加热时,因Zn2+水解,如果直接加热最终得到的是Zn(OH)2,因此要用浓盐酸或HCl气体抑制其水解的同时加热;
(2)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率;
Ⅱ.(1)如果CH3Cl能被酸性高锰酸钾氧化,则酸性高锰酸钾溶液本身会褪色,同时可能会生成CO2和Cl2,因此要注意尾气的处理;
(2)CH3Cl经过酸性高锰酸钾的洗气瓶会被氧化成CO2和Cl2,生成的Cl2可选择Na2SO3溶液,利用氯气的氧化性,将Na2SO3氧化为Na2SO4;
(3)因CH3Cl易溶于乙醇和丙醇等有机溶剂,因此的尾气可选择有机溶剂吸收。
Ⅰ.(1)ZnCl2为强酸弱碱盐,在加热ZnCl2晶体时可选择通HCl气体抑制其水解;
(2)为了提高甲醇的利用率,可以适当增加盐酸的量;
Ⅱ.(1)如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染;
(2)酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2,同时自身被还原成Mn2+,发生反应的离子方程式为10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4,发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+H+;
(3)CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气。


科目:高中化学 来源: 题型:
【题目】观察下表模型并结合有关信息,判断下列说法中不正确的是( )
B12结构单元 | SF6分子 | S8分子 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌片和铜片按不同方式插入稀硫酸中,下列说法正确的是( )

A. 甲中电子经导线从铜片流向锌片
B. 两烧杯中锌片上均发生还原反应
C. 两烧杯中铜片表面均无气泡产生
D. 一段时间后,两烧杯中溶液的c(H+)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示:
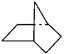
(1)写出其分子式____________。
(2)当降冰片烷发生一氯取代时,能生成_____________种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于______________________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________________。
a.能溶于水 b.能燃烧 c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应:![]() ,
,![]() 时该反应的平衡常数
时该反应的平衡常数![]() 。
。![]() 时,将一定量的
时,将一定量的![]() 和
和![]() 充入容积为某10L密闭容器发生上述反应,5min时达平衡,
充入容积为某10L密闭容器发生上述反应,5min时达平衡,![]() 只改变了一个条件,10min时再次达平衡,各物质物质的量
只改变了一个条件,10min时再次达平衡,各物质物质的量![]() 变化如下:
变化如下:
0min | 5min | 10min | |
CO |
|
| |
|
|
| |
| 0 |
| |
| 0 |
|
下列说法正确的是![]()
A.![]() 时用
时用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.![]() 改变的条件是再加入了
改变的条件是再加入了![]()
![]()
C.![]() 时,若向容器中充入
时,若向容器中充入![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]() ,达平衡时,
,达平衡时,![]() 的浓度为
的浓度为![]()
D.![]() 时,若向容器中充入
时,若向容器中充入![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]()
![]() 正
正![]() 逆
逆![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O基态原子核外电子排布式为____。H2O VSEPR模型名称为_____,立体构型为___。O3____极性分子(填“是”或“不是”)。
(2)利用热化学法来测定晶格能是由Born与Haber首先提出来的,其实质是利用Hess定律,构成一个热化学循环。
已知:Na(s)+ ![]() Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
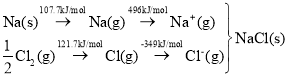
可知,Na原子的第一电离能为_____kJ·mol-1;Cl-Cl键键能为______kJ·mol-1;NaCl晶格能为_____kJ·mol-1。
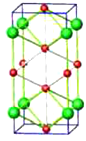
(3)高压下NaCl 晶体和 Na 或 Cl2 反应,可以形成不同组成、不同结构的晶体,如图是其中一种晶体的晶胞(大球为氯原子, 小球为钠原子),其化学式为________。
(4)金属Na晶体中的原子堆积方式称为体心立方堆积,晶胞参数为a nm,空间利用率为________(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com