
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是____________________________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是________________________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/(100gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有_______________________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为_________________________________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:

①过程Ⅴ生成N2的离子方程式为__________________________________。
②过程Ⅵ可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为________________________________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配成250 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.050 0 mol·L-1的碘水滴定(发生反应2S2O32-+I2==S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为________________________________。
【答案】 加快物质溶解 BaCl2溶液 BaCO3、Mg2(OH)2CO3 CO32-+2H+=CO2↑+H2O 2NH4++3ClO-==N2↑+3Cl-+2H++3H2O 8.5 89.28%
【解析】(1)因为溶解需要吸热,过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是加快物质溶解。
(2)因为SO42-+Ba2+= BaSO4难溶于水和酸的沉淀,所以过程Ⅱ是除去SO42-,需加入BaCl2溶液。
(3)①过程II剩余的滤液中含有的阳离子为Ca2+、Mg2+、Fe3+ Ba2+离子,加Na2CO3
后,过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3 BaCO3、Mg2(OH)2CO3。答案:BaCO3、Mg2(OH)2CO3。
②过程Ⅲ滤液中含有CO32-, 过程Ⅳ中调节pH时发生的主要反应的离子方程式为CO32-+2H+=CO2↑+H2O。
(4)由图 ①过程Ⅴ生成N2的离子方程式为2NH4++3ClO-==N2↑+3Cl-+2H++3H2O
①过程Ⅴ生成N2的离子方程式为2NH4++3ClO-==N2↑+3Cl-+2H++3H2O
②过程VI可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应为:5S2O32-+ 8IO3-+ H2O=5 I2+ 10SO42-+ 2H+氧化剂和还原剂的物质的量之比为8:5。
③根据题中表中的数据可知,第二次数据偏差较大,所以取一、三两次实验的数据,所以用去的碘水的体积为(28.82+28.78)/2mL=28.8mL,碘的物质的量为:0.0500molL-l×0.0288L=0.00144mol,
2S2O32-+I2═S4O62-+2I-,
2 1
x 0.00144mol
解x=0.00288mol,故Na2S2O35H2O的物质的量为0.00288mol,质量为:0.00288×248g/mol=0.714g,则称取8.0g产品,配制成250mL溶液中,Na2S2O35H2O的质量为=0.714g×250/25=7.14g。故产品的纯度为:7.14/8.0×100%=89.28%


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成Al2O3 , 将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,改用氢离子浓度相同的稀硫酸
C.Zn与稀硫酸反应时,适当提高溶液的温度
D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列是A、B、C、D、E五种短周期元素的某些性质:
性质 | A | B | C | D | E |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是____(填序号)。
a.![]() b.CH4 c.CH2
b.CH4 c.CH2![]() CHCH3d.CH3CH2C≡CH e.CH3CH3
CHCH3d.CH3CH2C≡CH e.CH3CH3
(2)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______(写化学式)
(3)B、D形成的简单氢化物,沸点:_______更高(写化学式)
II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是_______。
(2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__。
(3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。
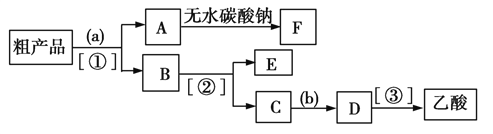
试剂a是____;分离方法③是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在臭氧发生器中装入100mLO2,经反应3O2=2 O3,最后气体体积变为95mL(体积均为标准状况下测定),则反应后混合气体的密度为____________。
(2)将溶质质量分数为a%NaOH溶液蒸发掉m g水后,变成VmL 2a%的NaOH不饱和溶液,则蒸发后的溶液的物质的量浓度是__________。
(3)amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为_______。
(4)现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的质量之比为________(最简整数比)。
(5)标准状况下,密度为0.75g/L 的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组需要1 molL﹣1的CuSO4 溶液80 mL,现用胆矾(CuSO4·5H2O)来配制,请回答下列问题:
(1)需称取胆矾 ______g。
(2)配制过程中,不需要的仪器(填序号)________。
A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.蒸发皿
完成配制实验还缺少的仪器是________。
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有_____(填序号)。
①转移前,容量瓶中含有少量蒸馏水 ②转移时有少量液体溅出
③定容时,俯视刻度线 ④颠倒摇匀后发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com