
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程: 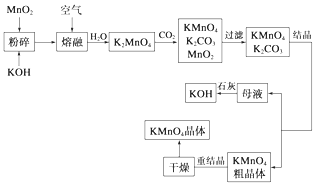
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列(填序号)物质相似.
A.75%酒精
B.双氧水
C.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式: .
(3)向K2MnO4溶液中通入CO2以制备KMnO4 , 该反应中的还原剂是 .
(4)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得mol KMnO4 .
【答案】
(1)BC
(2)2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O
2K2MnO4+2H2O
(3)K2MnO4
(4)![]()
【解析】解:(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒,A、酒精是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;B、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故正确;C、次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故正确;所以答案是:BC;(2)MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4 , 根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为﹣2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O; 所以答案是:2MnO2+4KOH+O2
2K2MnO4+2H2O; 所以答案是:2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O; (3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2 , 反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂;所以答案是;K2MnO4;(4)根据原子守恒知,1molMnO2可制得1molK2MnO4 , K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2 , 反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3 , 3mol锰酸钾生成2mol高锰酸钾,所以1mol二氧化锰生成
2K2MnO4+2H2O; (3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2 , 反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂;所以答案是;K2MnO4;(4)根据原子守恒知,1molMnO2可制得1molK2MnO4 , K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2 , 反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3 , 3mol锰酸钾生成2mol高锰酸钾,所以1mol二氧化锰生成 ![]() mol高锰酸钾;所以答案是:
mol高锰酸钾;所以答案是: ![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对以下科学家的发明发现,分析不合理的是( )
A.屠呦呦研究小组发现抗疟新药青蒿素,帮助很多人摆脱了疟疾的威胁
B.侯德榜制碱法,最终制得纯碱的化学式为:NaHCO3
C.阿伏加德罗提出分子学说,使人们对物质结构的认识发展到一个新的阶段
D.门捷列夫发现元素周期律,使化学的研究变得有规律可循
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2020年抗击新冠肺炎的战役中,化学物质发挥了重要作用。下列说法正确的是( )
A.医用消毒酒精中乙醇的体积分数为95%
B.生产医用防护口罩的原料聚丙烯纤维属于纯净物
C.抗病毒疫苗冷藏存放的目的之一是避免蛋白质变性
D.84消毒液可作为环境消毒剂,其有效成分为次氯酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com