
 已知尿素(结构简式:
已知尿素(结构简式: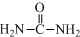 )可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.
)可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.分析 (1)Fe原子核外电子数为26,核外电子排布为1s22s22p63s23p63d64s2;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,NH3分子中氮是sp3杂化,氮周围有一对孤对电子对;尿素分子和水分子之间能形成氢键,所以尿素易溶于水;
(3)原子个数相等价电子数相等的微粒是等电子体;
(4)应用均摊法确定氧化物的化学式.
解答 解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,故答案为:[Ar]3d5;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;NH3分子中氮是sp3杂化,氮周围有一对孤对电子对,所以NH3分子的形状是三角锥形;尿素分子和水分子之间能形成氢键,所以尿素易溶于水,故答案为:N>O>C;三角锥形; 尿素分子和水分子之间能形成氢键;
(3)原子个数相等价电子数相等的微粒是等电子体,碳酸根与硝酸根离子互为等电子体,故答案为:CO32-;
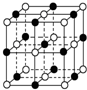
(4)晶胞示意图中铁和氧的原子个数都是4,所以氧化物的化学式为:FeO,故答案为:FeO.
点评 本题是对物质结构的考查,主要考查均摊法及晶胞结构的计算等基础知识,正确判断晶体结构是解题的关键,注意立体几何知识在解题中的灵活运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 31.3 g | B. | 27.9 g | C. | 25.6 g | D. | 19.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{12}{13}$ | B. | $\frac{1}{7}$ | C. | $\frac{6}{7}$ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
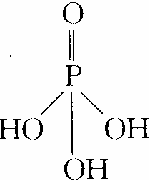 ),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2Pa)可用于化学镀镍等等.完成下列填空:
),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2Pa)可用于化学镀镍等等.完成下列填空: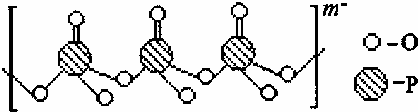
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  电解精炼铝 | B. | 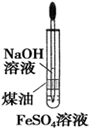 制备Fe(OH)3 | ||
| C. | 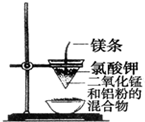 可制得金属锰 | D. | 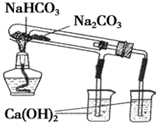 验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、甲苯、甲烷分子中的所有原子都在同一平面上 | |
| B. | 除去乙烷中的乙烯时,通入氢气并加催化剂加热 | |
| C. | C3H8的二氯代物共有3种 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com