
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 8种 |
分析 能使溴水褪色,说明含有碳碳双键,先考虑碳链异构,再考虑位置异构,顺反异构,说明双键上的碳原子连接不同的原子或原子团.
解答 解:能使溴水褪色,说明含有碳碳双键,主链有5个C原子时,相应烯烃有:CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3,其中CH3-CH═CH-CH2-CH3有2种顺反异构;主链有4个碳原子时,相应烯烃有:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2,都不存在顺反异构,即有3种异构,所以分子式为C5H10的烯烃共有(包括顺反异构):3+3=6种,故选C;
点评 本题综合考查有机物的结构和性质,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度不大,注意相关基础知识的积累.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 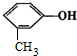 与 与 | B. | CH3-CH=CH2与 | ||
| C. | CH3-O-CH3和CH3CH2OH | D. | 正戊烷和异戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2→CO2+2H2O | B. | 2CH3CH2OH+O2→2CH3CHO+2H2O | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | CH2=CH2+Br2→CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 构成水的氢气和氧气都是可燃物,因此可研究在水不分解的情况下,使氢气成为二级能源 | |
| B. | 使太阳能聚焦,产生高温,使水分解生成氢气和氧气 | |
| C. | 研究特殊化学物质,开发廉价能源以分解水制取氢气 | |
| D. | 研究高效催化剂,使水分解产生氢气,同时释放能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O比Na2O2稳定 | B. | 均可与水反应生成氧气 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com