
| A. |  | B. |  | C. | 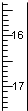 | D. | 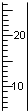 |
分析 量筒没有0刻度,量筒读数读到0.1mL,从下到上刻度增大;滴定管零刻度在上方,读数读到0.01mL;温度计零刻度以下有刻度;酸碱中和滴定时应该选用滴定管,据此解题.
解答 解:酸碱中和滴定时应该选用滴定管,滴定管零刻度在上方,从上到下刻度增大,读数读到0.01mL.
A.温度计零刻度以下有刻度,A应该是温度计,故A错误;
B.从下到上刻度增大,不是滴定管,故B错误;
C.从上到下刻度增大,读数读到0.01mL,C为滴定管,故C正确;
D.从下到上刻度增大,不是滴定管,应为量筒,故D错误.
故选C.
点评 本题考查常见仪器的构造及使用方法,题目难度不大,熟悉常见计量仪器的构造及使用方法.


科目:高中化学 来源: 题型:解答题
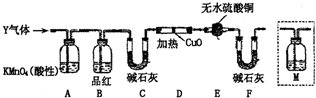 工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
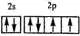 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL0.2mol/L氢氧化钠溶液 | B. | 100mL0.3mol/L醋酸溶液 | ||
| C. | 200mL0.2mol/L硫酸溶液 | D. | 150mL0.2mol/L盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的非金属元素都分布在p区 | |
| B. | 在CaO和SiO2晶体中都不存在单个小分子 | |
| C. | 单质中一定含有非极性键 | |
| D. | C2H6是碳链为直线型的非极性分子,可推测C3H4也是碳链为直线型的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 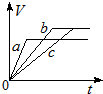 | B. | 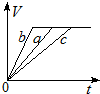 | C. | 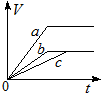 | D. | 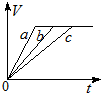 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5 mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,过氧化氢
,过氧化氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com