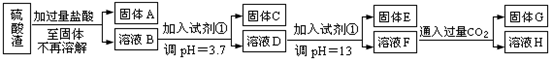
(2011?淄博二模)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO
2:约45%,Fe
2O
3:约40%,Al
2O
3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.
I.某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验(已知25℃氢氧化镁Ksp=5.6×10
-12;氢氧化铁Ksp=3.5×10
-38;一水合氨电离常数K=1.8×10
-5,其饱和溶液中c(OH
-)约为1×10
-3mol?L
-1).
方案一:

请回答:
(1)写出固体E的化学式:
Mg(OH)2
Mg(OH)2
.
(2)试剂①是
A
A
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是
CD
CD
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(4)溶液H中溶质的化学式:
NaCl、NaHCO3
NaCl、NaHCO3
(5)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为
灼烧
灼烧
.
(6)若不考虑溶液体积的变化,请计算溶液H中c(Mg
2+)=
5.6×10-10mol?L-1
5.6×10-10mol?L-1
.
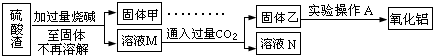
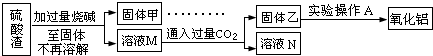
方案二:
请回答:
(7)此方案的主要问题有:
①产品不纯,最后产物中大多数是二氧化硅;②步骤多试剂消耗题量大
①产品不纯,最后产物中大多数是二氧化硅;②步骤多试剂消耗题量大
(8)写出由溶液M→固体乙这个过程中,最主要化学反应的离子方程式:
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO32-
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO32-
II.为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe
2+,再用KMnO
4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe
2++MnO
4-+8H
+=5Fe
3++Mn
2++4H
2O.
(1)判断到达滴定终点的现象是
滴下最后一滴KMnO4标准溶液时,溶液颜色变为紫红色,且在半分钟内不褪色
滴下最后一滴KMnO4标准溶液时,溶液颜色变为紫红色,且在半分钟内不褪色
.
(2)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL,试样溶液,用1.000×10
-2mol?L
-1KMnO
4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是
5.6%
5.6%
.