
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 名称是3,5-二甲基庚烷.
名称是3,5-二甲基庚烷. 名称是1,2-二甲苯.
名称是1,2-二甲苯. 名称是5,5-二甲基-2-己炔.
名称是5,5-二甲基-2-己炔. 名称是4-甲基-1-戊烯.
名称是4-甲基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
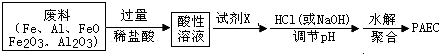
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
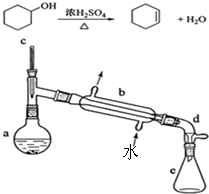 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:| 相对分子数量 | 密度 | 沸点 | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环乙烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
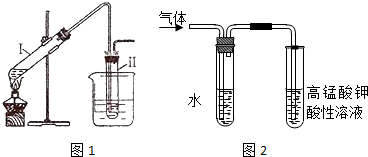
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com