
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
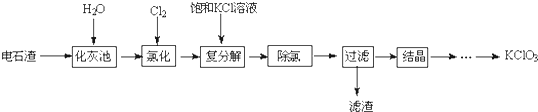
分析 电石渣(主要含CaO、CaC2及少量C、SiO2),电石渣加入水进入化灰池,碳化钙和水反应生成氢氧化钙和乙炔,通入氯气氯化和氢氧化钙反应在80℃生成氯化钙、氯酸钙和水,加入饱和KCl溶液,依据KClO3的溶解度比Ca(ClO3)2小,转化为KClO3的溶液,将溶液加热把多余的氯气除去,过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,
(1)化灰池中CaC2与水反应生成氢氧化钙和乙炔;
(2)在80℃氯化时,氯气和氢氧化钙反应产生氯酸钙及氯化钙和水;
(3)饱和KCl溶液能与氯酸钙反应生成KClO3;
(4)上述分析可知过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体.
解答 解:电石渣(主要含CaO、CaC2及少量C、SiO2),电石渣加入水进入化灰池,碳化钙和水反应生成氢氧化钙和乙炔,通入氯气氯化和氢氧化钙反应在80℃生成氯化钙、氯酸钙和水,加入饱和KCl溶液,依据KClO3的溶解度比Ca(ClO3)2小,转化为KClO3的溶液,将溶液加热把多余的氯气除去,过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,
(1)化灰池中CaC2与水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)在80℃氯化时,氯气和氢氧化钙反应产生氯酸钙及氯化钙和水,反应的化学方程式为:6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O,除去溶液中多余的氯气的简单方法是将溶液加热除去,
故答案为:6Cl2+6Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 5CaCl2+Ca(ClO3)2+6H2O,溶液加热除去;
(3)饱和KCl溶液能与氯酸钙反应的原因是,KClO3的溶解度比Ca(ClO3)2小,饱和KCl溶液能与氯酸钙反应生成KClO3,
故答案为:KClO3的溶解度比Ca(ClO3)2小;
(4)上述分析可知过滤得到滤渣主要有不溶的C、SiO2,蒸发浓缩,冷却结晶,趁热过滤得到析出KClO3的晶体,故答案为:C、SiO2;蒸发结晶;趁热过滤.
点评 本题考查了物质分离提纯的过程分析判断,实验条件和物质性质的理解应用,实验设计和反应产物的判断是晶体关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
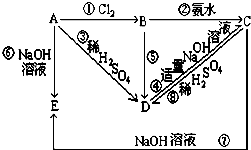 已知A为金属单质,根据下列变化完成以下问题:
已知A为金属单质,根据下列变化完成以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
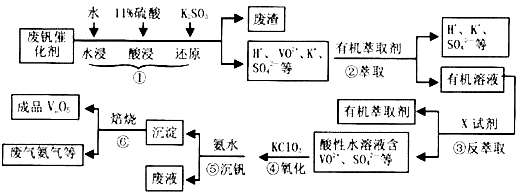
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
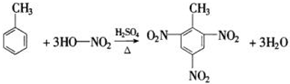
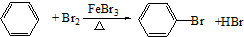
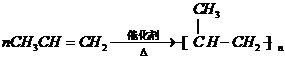
 -CH2CH3+18KMnO4+27H2SO4→5HOOC-
-CH2CH3+18KMnO4+27H2SO4→5HOOC- -COOH+9K2SO4+18MnSO4+5CO2↑+42H2O
-COOH+9K2SO4+18MnSO4+5CO2↑+42H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
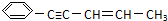 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 有7个碳原子在同一条直线上 | D. | 有5个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
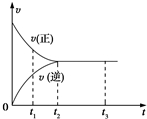 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com