
| 1×10-12 |
| 1×10-8 |
| 10-12 |
| 10-7 |
| 1×10-12 |
| 1×10-8 |
| 10-12 |
| 10-7 |
| 1×10-4×Y-1×10-4×X |
| X+Y |


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
| A、将25g CuSO4?5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液 |
| B、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 |
| C、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| D、用银氨溶液鉴别葡萄糖和蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
| A、溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B、方案一可能产生氢气,方案二可能剩余铜 |
| C、若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| D、实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L Na2S2O3和H2SO4各5 mL,加水5 mL,反应温度10℃ |
| B、0.1 mol/L Na2S2O3和H2SO4各5 mL,加水10 mL,反应温度10℃ |
| C、0.1 mol/L Na2S2O3和H2SO4各5 mL,加水5 mL,反应温度30℃ |
| D、0.2 mol/L Na2S2O3和H2SO4各5 mL,加水10 mL,反应温度30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 | ||||
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | ||||
C、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
| ||||
| D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ?mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ?mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
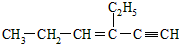 分子中处于四面体结构中心的碳原子数为a,一定在同一平面内的碳原子数为b,一定在同一直线上的碳原子数为c,则a,b,c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定在同一平面内的碳原子数为b,一定在同一直线上的碳原子数为c,则a,b,c依次为( )| A、4,5,3 |
| B、4,6,3 |
| C、2,4,5 |
| D、4,4,6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com