
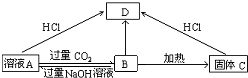
分析 (1)若A为钠盐,转化关系中溶液A由B和过量的氢氧化钠溶液反应得到,B受热分解生成固体C,判断B为Al(OH)3,C为Al2O3,A为NaAlO2,D为AlCl3;
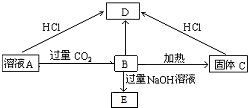
(2)若A为二元碱,其金属阳离子核外有18个电子为钙离子,判断A为Ca(OH)2,B为Ca(HCO3)2,B加热得到固体C为CaCO3,则E为Na2CO3,D为CaCl2.
解答 解:(1)若A为钠盐,转化关系中溶液A由B和过量的氢氧化钠溶液反应得到,B受热分解生成固体C,判断B为Al(OH)3,C为Al2O3,转化关系为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,NaAlO2+4HCl=NaCl+AlCl3+2H2O,Al2O3+6HCl=2AlCl3+3H2O,A为NaAlO2,D为AlCl3,
故答案为:NaAlO2;Al(OH)3;Al2O3;AlCl3 ;
(2)若A为二元碱,其金属阳离子核外有18个电子为钙离子,判断A为Ca(OH)2,B为Ca(HCO3)2,B加热反应得到固体C为CaCO3,反应的化学方程式为:Ca(OH)2+CO2=Ca(HCO3)2,Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CaCO3↓+CO2↑,Ca(HCO3)2+2NaOH=2H2O+CaCO3↓+Na2CO3,Ca(OH)2+2HCl=CaCl2+2H2O,CaCO3+2HCl=CaCl2+CO2↑+H2O,则E为Na2CO3,D为CaCl2;
故答案为:Ca(OH)2 ;Ca(HCO3)2 ;CaCO3 ;CaCl2 ;Na2CO3.
点评 本题考查了无机物的相互转化、物质性质、反应产物的分析判断,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸溶液没有产生白色沉淀,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
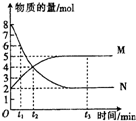 一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g)△H<0,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g)△H<0,M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3为氧化物 | B. | 该反应为置换反应 | ||
| C. | 该反应方程式中的x为3 | D. | 该反应会放出大量热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别Fe(NO3)3溶液和Fe2(SO4)3溶液 | |
| B. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| C. | 将某气体通入品红溶液中,溶液褪色,说明该气体一定是SO2 | |
| D. | 用铂丝蘸取溶液在酒精灯火焰上灼烧,若火焰呈黄色,则溶液中一定含有K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com