
【题目】煤炭燃烧时产生大量SO2、NO对坏境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
ii:C0(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ/mol
CO2(g)+H2(g) △H2=-41.2kJ/mol
iii:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。甲醇还可以与乙酸反应制香料,反应为:CH3OH(l)+CH3COOH(l)![]() CH3COOCH3(l)+H2O(l)
CH3COOCH3(l)+H2O(l)
①△H3=_______制香料反应的平衡常数K 的表达式为____________。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:V正_____V逆 (填“>”、“<”或“=”)。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/mol/L | 0.2 | 0.2 | 0.4 | 0.4 |
(2)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低然煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
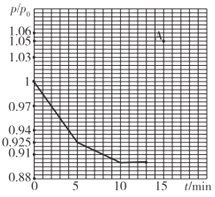
①0~5min内,该反应的平均反应速率V(N2)=______;平衡时NO的转化率为________。
②若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内p/p0的比值应在图中A点的______(填"上方”或“方”)。
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO),装置如图所示:

①阴极区的电极反应式为_________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
【答案】 -132.0kJ/mol ![]() > 3×10-3mol/(L·min) 80% 下方 2SO32-+4H++2e-=S2O42-+2H2O 1344
> 3×10-3mol/(L·min) 80% 下方 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】(1)①反应ⅲ=反应ⅰ+反应ⅱ,所以△H3=△H1+△H2=-90.8+(-41.2)=-132.0kJ/mol。该反应的平衡常数表达式为K=![]() 。注意这里的水不是溶剂所以应该有浓度,不能视为1。②10min时反应ⅰ的浓度商Q=
。注意这里的水不是溶剂所以应该有浓度,不能视为1。②10min时反应ⅰ的浓度商Q=![]() <K1=160,所以反应正在向正反应方向进行,V正>V逆。
<K1=160,所以反应正在向正反应方向进行,V正>V逆。
(2)①同温同体积下,压强的比等于气体的物质的量的比,5分钟的时候压强是初始压强的0.925倍,所以气体的物质的量是初始物质的量的0.925倍,即5分钟的时候物质的量为(0.1+0.3)×0.925=0.37mol,减少了0.03mol气体。反应为2NO(g)+2CO(g)=N2(g)+2CO2(g),每反应2molNO和2molCO生成1molN2和2molCO2,气体的物质的量会减少1mol,所以可以认为每生成1molN2会减少1mol气体。上面计算出来气体减少了0.03mol,所以生成0.03molN2,则![]() 。达平衡时的压强是初始压强的0.9倍,所以平衡时的总物质的量为(0.1+0.3)×0.9=0.36mol,气体的物质的量一共减少0.04mol,由上所述可以得到:生成0.04molN2,所以反应的NO为0.08mol,其转化率为0.08÷0.1=80%。②根据①中计算的数据,第一次达平衡时,总物质的量为0.36mol,加入0.06molCO,瞬间总物质的量变为0.42mol,此时p/p0=0.42/0.4=1.05(就是A点的纵坐标)。因为加入CO,所以反应的平衡向正反应方向移动,气体的物质的量还会减少,所以p/p0的数值会减小,达到新平衡时,p/p0的数值一定在A点下方。
。达平衡时的压强是初始压强的0.9倍,所以平衡时的总物质的量为(0.1+0.3)×0.9=0.36mol,气体的物质的量一共减少0.04mol,由上所述可以得到:生成0.04molN2,所以反应的NO为0.08mol,其转化率为0.08÷0.1=80%。②根据①中计算的数据,第一次达平衡时,总物质的量为0.36mol,加入0.06molCO,瞬间总物质的量变为0.42mol,此时p/p0=0.42/0.4=1.05(就是A点的纵坐标)。因为加入CO,所以反应的平衡向正反应方向移动,气体的物质的量还会减少,所以p/p0的数值会减小,达到新平衡时,p/p0的数值一定在A点下方。
(3)①阴极应该是将SO32-得电子转化为S2O42-,即将+4价S转化为+3价的S,所以2个SO32-得2个电子转化为1个S2O42-,反应物中再补充氢离子,生成物补充水分子,根据原子个数守恒和电荷守恒配平得到:2SO32-+4H++2e-=S2O42-+2H2O。②NO吸收转化后的主要产物为NH4+,即N的化合价由+2降低为-3,所以1个NO得到5个电子,即NO的物质的量是转移电子的物质的量的1/5,当转移0.3mole-时反应的NO为0.06mol,体积为1344mL。


科目:高中化学 来源: 题型:
【题目】常温下,溶液中金属离子(Mn+)的pM[pM=-lgc(Mn+)]随溶液pH变化关系如右图所示[假定c(Mn+)≦10-6mol/L认为该金属离子沉淀完全]。下列说法不正确的是

A. 四种金属的难溶氢氧化物中Ksp[Mg(OH)2]最大
B. 可以通过调节pH的办法沉淀Fe3+
C. pM、Ksp及pH之间的关系为pM=npH+lgKsp-14n
D. Fe2+和Mg2+混合溶液中滴入NaOH溶液、当Mg2+开始沉淀时,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+) =0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是( )
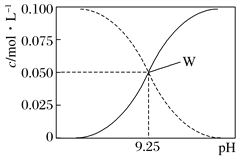
A. pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
B. pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1mol·L-1
C. W点表示溶液中:c(NH4+)+c(H+)=c(OH-)
D. 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置图1中A的名称是________,B的名称是_______。A中一般要加入碎瓷片,其作用是________________。装置图4中盛溶液的仪器名称是________。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
②步骤③的实验选择上述装置图____(填图的序号)。步骤⑤的实验操作名称是_____,选择上述装置图____(填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_________,选择上述装置图___(填图的序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是

A. 电池工作时,光能转变为电能,X为电池的正极
B. 镀铂导电玻璃的作用是传递I-
C. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
D. 电池的电解质溶液中I-和I3-的浓度均不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照无机物的分类方法,下列各组物质中,属于不同类型的物质是( )
A.火碱、烧碱、生石灰
B.生石灰、冰、干冰
C.熟石灰、苛性钠、氢氧化钾
D.纯碱、硫酸钠、胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com