
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
【解析】
A中圆度烧瓶在加热条件下可提供水蒸气,B在加热条件下,铁与水蒸气反应生成四氧化三铁和氢气,氢气经干燥,在C中用向下排空法可收集到氢气,D为干燥装置,在加热条件下氢气与氧化铜反应生成铜和水,据此解答该题。
(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)装置B中铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠;
(3)在固体中加入过量稀盐酸后四氧化三铁、铁和盐酸以及铁和氯化铁之间发生反应,其方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,因此步骤I中通入Cl2的作用是将Fe2+氧化成Fe3+;
②检验三价铁应该用KSCN溶液,观察是否变红,即检验滤液中Fe3+的操作方法是:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
③由FeCl3稀溶液得到FeCl36H2O晶体需加热浓缩、冷却结晶、过滤。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用。下列化学反应中,不符合绿色化学概念的是
A. 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3
B. 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O
C. 制硫酸铜:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制硫酸铜:2Cu+O2![]() 2CuO , CuO+H2SO4(稀)=CuSO4+H2O
2CuO , CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰。
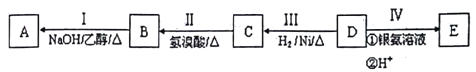
请回答:
(1)D的分子式为______;
(2)B中所含官能团的名称为_______;
(3)Ⅲ的反应类型为_______(填字丹序号);
a. 还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)写出下列反应的化学方程式:
I:_____________________________;
C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为______________________________________;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,它们的结构简式为_____和__________________________;
(6)E有多种同分异构体,其中含有![]() 结构的有________种;(不包括E)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为_______。
结构的有________种;(不包括E)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图一所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液,足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
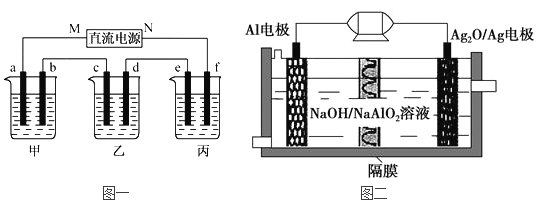
(1)图一中的直流电源为一种性能优良的Al-Ag2O电池,其原理如图二所示。该电池中铝是负极,试写出电池工作时的正极反应式__________________和电池的总化学反应方程式______________。
(2)接通电源后,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______极;c电极上发生______反应(“氧化”或“还原”);
②电极b上发生的电极反应为___________________;
③列式计算电极b上生产的气体在标准状况下的体积_______;
④电极c的质量变化是_____g;
⑤电解前后各溶液的pH是否发生变化(“增大”、“减小”或“不变”)
甲溶液_________;乙溶液_________;丙溶液______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)正四面体烷的分子为_________,其二氯取代产物有_______种。
(2)关于乙烯基乙炔分子的说法错误的是:____________。
a.能使酸性KMnO4溶液褪色
b.乙烯基乙炔分子内含有两种官能团
c.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃(含有苯环的烃)的分子的结构简式:_________________________________________。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、K+、Cl-、SO32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C. ![]() 的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+
D. 由水电离出的c(H+) =10-12mol/L的溶液:Na+、K+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
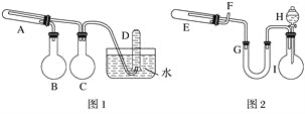
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是____________;烧瓶C的作用是__________;在试管D中收集得到的是__________。
(2)实验时,U形管G中应加入的试剂是____________;长颈漏斗H中应加入____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________________。
(4)试管E中发生反应的化学方程式是__________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须____________;E管中的反应开始后,在F出口处应________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:

(1)通入CO2前,灯泡________(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度________。
(3)继续通入过量的CO2,灯泡的亮度________。
(4)下列四个图中,________(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com