
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。下列关于固体

燃料电池的有关说法中正确的是
A. 固体氧化物的作用是让电子在电池内通过
B. 固体氧化物中O2-从a极向b极移动
C. 电极b为电池的负极,电极反应式为:O2 + 4e- = 2O2-
D. 若以C3H8为燃料气,则接触面上发生的反应为C3H8 – 20e- + 10O2- =3CO2 +4H2O
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A. 烧菜用过的铁锅,经放置常出现红棕色斑迹
B. 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C. 牛奶久置变质腐败
D. 氧化铜固体加入稀盐酸中,完全溶解
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料
B. 绿色化学的核心是对环境产生的污染进行治理
C. 氯化铵、二氧化硫溶于水都能导电,所以它们都属于电解质
D. 云、烟、雾等均能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则对( )
A. 高碘酸和碘酸都是强酸 B. 高碘酸和碘酸都是弱酸
C. 高碘酸是弱酸、碘酸是强酸 D. 高碘酸是强酸、碘酸是弱酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:实验题
我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务。(部分装置如图),其反应原理及步骤如下:
4MnO4-+5HCHO+H+=Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
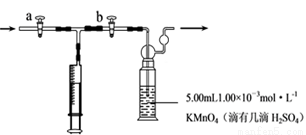
步骤:①量取5.00mL 1.00×10-3mol·L-1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10-3mol·L-1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气。再将注射器气体推入洗气瓶中充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL)。3次实验消耗草酸溶液的体积平均值为12.38mL。
回答下列问题
(1)5.00mL高锰酸钾用_____________________量取。
(2)此实验用指示剂__________(填字母)。
a甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(3)计算该居室内空气中甲醛的浓度_______________mg·m-3。
(4)下列操作能引起室内甲醛浓度偏高的是____________。
a.滴定终点俯视读数
b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水
d.装草酸的滴定管未润洗
(5)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向10 mL 0.01 mol•L-1 H2C2O4溶液中滴加0.01 mol•L-1 NaOH溶液
①当加入的NaOH溶液体积为10 mL,请你写出溶液中质子守恒关系式_______。
②当加入的NaOH溶液体积为20 mL,请你写出溶液中离子的浓度大小关系_____。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知图一表示的是可逆反应A(g)+B(g) C(s)+D(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+D(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
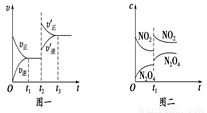
A. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
B. 图一t2时改变的条件可能是升高了温度或增大了压强
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质的性质或该物质性质的应用均正确的是
A. 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些
B. 明矾净水与自来水的杀菌清毒原理是一样的
C. MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属
D. 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:简答题
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
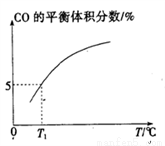
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
用石墨作电极电解0.1mol L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )
L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )
A. 在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态
B. 在电解质溶液中通入标准状况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态
C. 阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍
D. 阳极产生的气体的平均摩尔质量为58g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com