
将64 g铜箔加入到盛有含2 mol H2SO4的浓H2SO4试管中加热。
(1)铜箔能否完全溶解?请解释原因。
(2)在反应后的溶液中再加入少量硝酸钠晶体,铜箔表面又有气泡冒出,其原因为________________________________________________________________________
________________________________________________________________________。
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.0 mL,则该样品中N的含量为________(保留两位小数)。
[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,错误的是( )
A.分子晶体中范德华力没有方向性和饱和性,所以分子晶体一般都采用密堆积,但要受到分子形状的影响
B.离子晶体一般都是非等径圆球的密堆积
C.由于共价键的方向性和饱和性,原子晶体堆积的紧密程度大大降低
D.金属晶体采用非等径圆球的密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液能够区别SO2和CO2气体的是( )
①澄清的石灰水 ②H2S溶液 ③酸性KMnO4溶液
④氯水 ⑤品红溶液
A.①②③ B.②③④
C.除①以外 D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br-、SO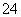 、H2SO3、NH
、H2SO3、NH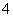 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO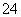 C.H2SO3 D.NH
C.H2SO3 D.NH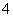
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同( )
(2014·大纲全国卷,8A)
(2)用KOH溶液鉴别SO3(g)和SO2( )
(2014·重庆理综,2A)
(3)二氧化硫可广泛用于食品的增白( )
(2013·四川理综,1A)
(4)Na2S2O3溶液中加入稀硫酸的离子方程式:2S2O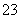 +4H+===SO
+4H+===SO +3S↓+2H2O( )
+3S↓+2H2O( )
(2013·四川理综,3D)
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫是控制二氧化硫污染的主要技术手段。
(1)利用海水脱硫是一种有效的方法,其工艺流程如图所示:
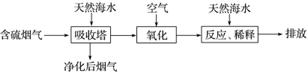
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示:

①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是________(填字母)。
A.降低通入含硫烟气的温度
B.减小通入含硫烟气的流速
C.减少天然海水的进入量
D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的离子方程式:_______________________________________________________________
________________________________________________________________________。
③该小组采用如图装置在实验室测定烟气中SO2的体积分数(假设实验在标准状况下进行)。
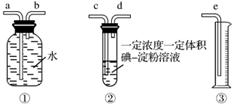
上述装置连接的顺序是原料气→________(填a、b、c、d、e)。下列试剂中(浓度、体积一定),可以用来代替试管中的碘淀粉溶液的是________(填字母)。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
(2)石灰石石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4·2H2O)。写出该反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
某电厂用煤300 t(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏________ t。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。
(1)汽车尾气中的CO来自于______________________,NO来自于_________________。汽车尾气对环境的危害主要有________________________(至少填两种)。
(2)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_________________。
(3)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com