
 .
.分析 (1)烃燃烧生成二氧化碳和水,由0.2mol烃燃烧生成二氧化碳和水各1.2mol可知有机物的分子式为C6H12;
(2)由分子组成可知,生成CO2和H2O各3mol,烃为0.5mol,可确定烃的质量和消耗的氧气;
(3)若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,说明烃中不含碳碳双键,应为环烷烃,即环己烷;
(4)烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,说明烃中含有C=C,其中,含有4个甲基的有3种,其碳架结构为(①②③处可分别不同时安排双键): ,以此确定烯烃;
,以此确定烯烃;
(5)比烃A少一个碳原子且能发生反应而使溴水褪色的A为戊烯,先找出碳链异构,然后计算出加入双键后的种类;
(6)烃A能使溴水褪色,所有碳原子都在同一平面上,则所有的碳原子连接在C=C上.
解答 解:(1)某烃A 0.2mol 在氧气中完全燃烧后,生成CO2和H2O各1.2mol,则分子中含有N(C)=6,n(H)=12,分子式为C6H12,
故答案为:C6H12;
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,由分子组成可知烃为0.5mol,质量为0.5mol×(84g/mol)=42g,
消耗氧气的物质的量为0.5mol×(6+$\frac{12}{4}$)=4.5mol,
体积为4.5mol×22.4L/mol=100.8L,
故答案为:42;100.8;
(3)C6H12只有1个不饱和度,若烃A不能使溴水褪色,则其为环烷烃.其中,能与氯气发生取代反应,其一氯代物只有一种的是环己烷,即 ,
,
故答案为: ;
;
(4)烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,说明烃中含有C=C,其中,含有4个甲基的有3种,其碳架结构为(①②③处可分别不同时安排双键): ,烃A可能有的结构简式为(CH3)3C-CH=CCH2、CH3-C(CH3)=C(CH3)-CH3、CH3CH(CH3)-C(CH3)=CH2等,与HCl加成后有两种产物,则(CH3)3C-CH=CCH2、CH3CH(CH3)-C(CH3)=CH2符合,
,烃A可能有的结构简式为(CH3)3C-CH=CCH2、CH3-C(CH3)=C(CH3)-CH3、CH3CH(CH3)-C(CH3)=CH2等,与HCl加成后有两种产物,则(CH3)3C-CH=CCH2、CH3CH(CH3)-C(CH3)=CH2符合,
故答案为:(CH3)3C-CH=CCH2、CH3CH(CH3)-C(CH3)=CH2;
(5)比烃A少一个碳原子且能发生反应而使溴水褪色,说明含有碳碳双键,所以A为戊烯,
碳架异构有三种:主链5个碳原子:C-C-C-C-C:加入双键方式有2种,分别为:CH2=CH-CH2-CH2-CH3、CH3-CH=CH-CH2-CH3,
主链四个碳原子 ,加入双键方式有3种,分别为CH2=C(CH3)-CH2-CH3、CH3-C(CH3)=CH-CH3、CH3-CH(CH3)-CH=CH2,
,加入双键方式有3种,分别为CH2=C(CH3)-CH2-CH3、CH3-C(CH3)=CH-CH3、CH3-CH(CH3)-CH=CH2,
主链三个碳原子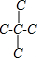 ,由于中间的碳原子达到饱和,不可能存在碳碳双键,
,由于中间的碳原子达到饱和,不可能存在碳碳双键,
所以总共存在5种戊烯的同分异构体,
故答案为:5;
(6)若烃A能使溴水褪色,所有碳原子都在同一平面上,则所有的碳原子连接在C=C上,应为CH3-C(CH3)=C(CH3)-CH3,故答案为:CH3-C(CH3)=C(CH3)-CH3.
点评 本题考查有机物的推断,侧重于分子式和结构简式的确定,题目难度不大,注意推断有机物分子式的角度,根据物质的性质推断可能的结构特点.


科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应的离子方程式:Na+H2O═Na++OH-+H2↑ | |
| B. | 铁与水蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| C. | 镁、铝与沸水不可能反应 | |
| D. | 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+═2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
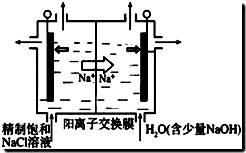
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
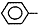 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为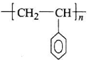 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com