
【题目】现有下列10种物质①熔融的氢氧化钠②蔗糖③纯净的盐酸④金属钠⑤硫酸⑥二氧化硫⑦硫粉⑧偏铝酸钠溶液⑨酒精溶液⑩液氨(注意:下面前三问的答案请填序号!)
(1)属于电解质的有__。
(2)属于非电解质的有__。
(3)上述状态下的电解质能导电的有__。
(4)偏铝酸钠溶液中通足量二氧化碳反应的离子方程式:__。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】利用有机物X在一定条件下可合成植物生长所需的“平衡因子”Y(部分产物未写出)。已知含有“手性碳原子”的分子可形成对映异构体。下列有关说法中正确的是( )
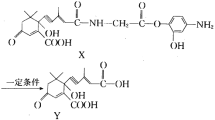
A.X,Y分子都不存在对映异构体
B.X分子中所有碳原子可能都在同一平面
C.Y分子可以发生取代、酯化、消去、加成、氧化等反应
D.未写出的产物可能有2种,且都具有两性化合物的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳元素广泛存在于自然界中,对人类生命和生活具有重要意义。含碳化合物在工业生产和国防建设中有广泛的应用。
(1)碳元素原子核外有_____个未成对电子,最外层有_____种能量不同的电子。CH4 分子的空间构型为_____,是_____分子。(填“极性”或“非极性”)
(2)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是_____(填编号)
a.CH4的稳定性比SiH4强 b.SiH4的沸点比CH4高
c.碳酸是强酸,硅酸是弱酸 d.碳原子半径比硅原子小
II.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式K_____。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”)
(2)任写两种能提高二氧化硅转化率的措施_____、_____。
(3)一定温度下,在2 L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4mol,用CO表示该反应时间内的反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
C. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
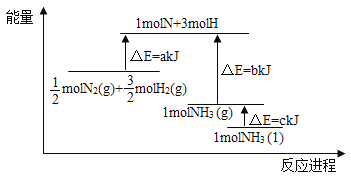
A. 若合成氨反应使用催化剂,反应放出的热量增多
B. 断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(molL﹣1s﹣1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系:υ(B)=3υ(A); 3υ(C)=2υ(B)。则此反应可表示为( )
A. 2A+3B![]() 2CB. A+3B
2CB. A+3B![]() 2C
2C
C. 3A+B![]() 2CD. A+B
2CD. A+B![]() C
C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
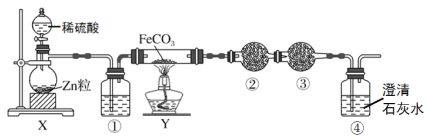
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
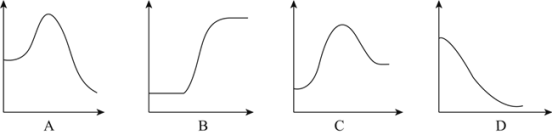
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com