
| A. | 品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | |
| C. | 分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结 | |
| D. | 溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
分析 A.氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,是次氯酸的强氧化性的体现,二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质;
B.前者是盐析,后者是蛋白质变性;
C.氯化铵加热分解,而碘升华;
D.从植物油和裂化汽油中都含有双键分析.
解答 解:A.氯气的漂白作用是氯气和水反应生成的次氯酸的漂白作用,是次氯酸的强氧化性的体现;二氧化硫的漂白作用是二氧化硫与水生成的亚硫酸和有色物质结合为不稳定的无色物质,该过程为化合反应,不能体现二氧化硫具有氧化性,二者原理不同,故A错误;
B.加入NaCl溶液蛋白质发生盐析为物理变化,加入HgCl2溶液蛋白质发生变性为化学变化,二者原理不同,故B错误;
C.氯化铵加热分解,而碘升华,分别发生化学变化、物理变化,二者原理不同,故C错误;
D.植物油和裂化汽油中都含有碳碳双键,可以发生加成反应使溴水褪色,二者原理相同,故D正确;
故选D.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
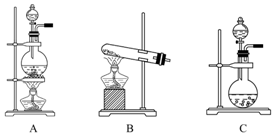 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
| A. | 反应在 t1min 内的平均反应速率为υ(CO2)=0.40/t1mol/(L•min) | |
| B. | 到 t1min 时,反应未达到平衡状态 | |
| C. | 温度升至 800℃时,上述反应的平衡常数为 0.64,则正反应为放热反应 | |
| D. | 保持 700℃不变,向平衡体系中再通入 0.60 mol CO 和 0.30 mol H2O,达到新的平衡,与原平衡相比,CO的转化率增大,H2的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓盐酸与铁屑反应制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com