
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
分析 A、烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,金属钠的密度大于煤油小于水,故钠块应位于煤油和水的分界面处;
B、钠遇水发生反应生成氢气,故钠块应在界面处上下跳动;
C、因钠的密度比水小,应浮在水面上;
D、钠与水反应放热且钠的熔点低,故钠熔化成闪亮的小球,在两液体界面附近上下跳动.
解答 解:A、因钠与煤油不反应,且钠的密度比煤油大,应沉于煤油底部,故A错误;
B、因钠的密度比水小,比煤油大,因此介于两者之间,在与水反应生成气体后被气体带离水层,进入煤油层后停止反应又下沉,如此往复,直至钠反应完.故B错误;
C、因钠的密度比水小,应浮在水面上,故C错误;
D、因钠的密度比水小,比煤油大,因此介于两者之间,在与水反应生成气体后被气体带离水层,进入煤油层后停止反应又下沉,如此往复,直至钠反应完,故D正确;
故选D.
点评 本题主要考查了钠的物理性质,借助于题目情境,培养了学生分析问题的能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NH4++H2O═NH3•H2O+H+ | D. | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
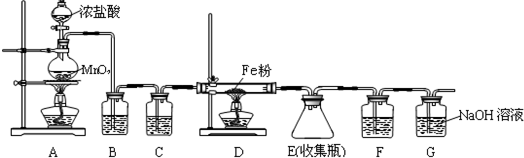
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60乙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HO3-和CO32-E离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 同温、同压、同体积的CO和NO含有的质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
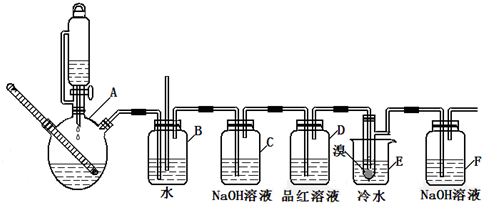
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.
欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
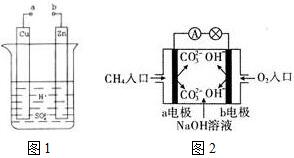 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com