
| A. | 侯式制碱法制纯碱 | B. | 海带提碘 | ||
| C. | 氯碱工业 | D. | 海水提溴 |
分析 含元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.侯式制碱法制纯碱中二氧化碳、氨气、氯化钠反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分解转化为碳酸钠,二氧化碳和水,均没有元素的化合价变化,则不涉及氧化还原反应,故A选;
B.海带提碘是由碘离子变为I2,有元素化合价的变化,属于氧化还原反应,故B不选;
C.氯碱工业中电解食盐水生成氢气、氯气,H、Cl元素的化合价变化,为氧化还原反应,故C不选;
D.海水中溴以离子存在,与氧化剂发生氧化还原反应生成溴单质,有元素化合价的变化,属于氧化还原反应,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
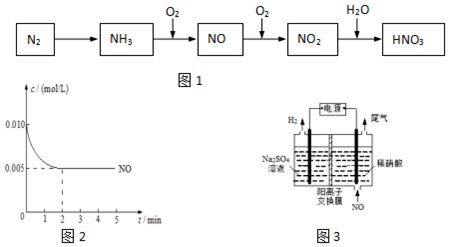
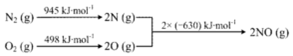
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
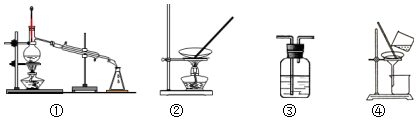
| A. | 用浓硫酸干燥SO2,选③ | |
| B. | 从食盐溶液中获取NaCl,选② | |
| C. | 除去自来水中的Cl-,制纯净水,选④和① | |
| D. | 除去Fe(OH)3胶体中的难溶物,选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量 (mg/L) |
| 硝酸钙 | 260 |
| 硫酸钾 | 250 |
| 磷酸二氢铵 (NH4H2PO4) M=115g/mol | 345 |
| 硫酸镁 | 537 |
| 硫酸铵 | 237 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
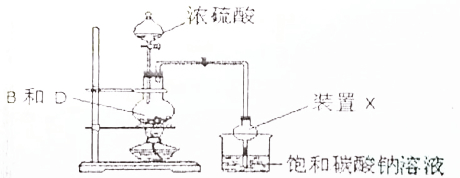
| A. | 反应中浓硫酸的作用是催化剂、吸水剂 | |
| B. | 饱和碳酸钠溶液可用饱和氢氧化钠溶液代替 | |
| C. | 实验结束后烧杯中的溶液经震荡、静置、分液,能得到纯净的乙酸乙酯 | |
| D. | 装置X的作用能防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22g N2O和CO2的混合物中所含电子数为11NA | |
| B. | 12g石墨烯(单层石墨)中含有C-C键的数目为3NA | |
| C. | 与铁反应时,消耗22.4L(标准状况)Cl2转移的电子数定为3NA | |
| D. | 若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,则胶休微粒数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性的雨水通常称为酸雨 | |
| B. | 翡翠、玛瑙、水晶等饰物都是硅酸盐制品 | |
| C. | 合金材料一定全部由金属元素组成 | |
| D. | 硅是制作太阳能电池的主要原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com