
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
分析 A.碱不能除去烃类化合物;
B.耐高温材料应具有较高的熔点;
C.二氧化硫不能漂白指示剂;
D.钠的金属性弱于钾,Na的沸点高于K.
解答 解:A.矿物油渍属于烃类化合物,碱和烃类化合物不反应,所以不能用纯碱除去矿物油渍,故A错误;
B.氧化铝的熔点很高,可用于制作耐高温材料,故B正确;
C.二氧化硫不能漂白指示剂,所以遇到石蕊只变红不褪色,故C错误;
D.Na的金属性比K弱,在850℃时使K蒸汽分离出,而钠为液体,可用钠制取钾,利用的是高沸点金属制备低沸点金属,故D错误;
故选:B.
点评 本题考查了物质的用途,性质决定用途,明确物质的性质是解题关键,注意氧化铝为两性氧化物,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 离子键是阴、阳离子之间的吸引力 | |
| C. | 离子化合物可以含共价键 | |
| D. | 分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
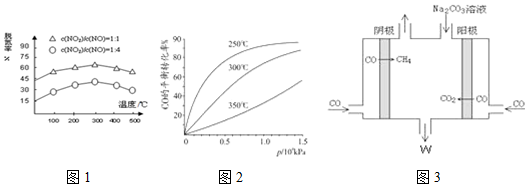
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgNO3溶液中加入Cu粉:Cu+2Ag+═Cu2++2Ag | |
| B. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 饱和FeCl3溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中滴入少量盐酸,然后滴入少量的氯化钡溶液 | 先无明显现象,后有白色沉淀. | 说明原溶液中含有SO42- |
| B | 向某氯化亚铁溶液中滴入少量氯水,然后滴入少量的KSCN溶液 | 溶液变成血红色 | 说明原氯化亚铁已氧化变质 |
| C | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液 | 实验开始立即产生白色沉淀 | X可能是NaHCO3 |
| D | 向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 在100mL的量筒里稀释浓硫酸溶液50mL | |
| D. | 用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
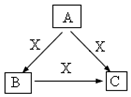 按要求完成下列各题:
按要求完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S原子核内中子数为16 | B. | 2H+的酸性比1H+的酸性更强 | ||
| C. | 16O与18O的化学性质几乎完全相同 | D. | 13C和15N原子核内的质子数相差2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
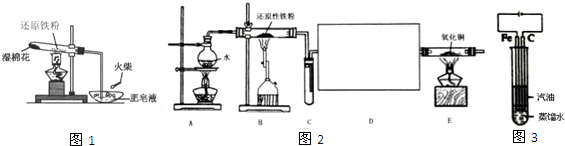
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com