
| A.品红溶液 | B.澄清的石灰水 | C.溴水 | D.酸性高锰酸钾溶液 |
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
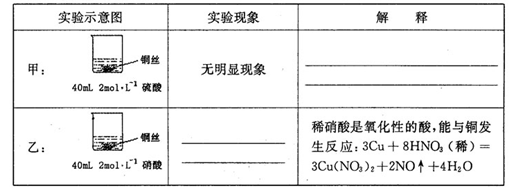
| A.出现钝化现象:浓硝酸会,稀硝酸不会 |
| B.消耗HNO3的物质的量:前者多,后者少 |
| C.反应生成气体的颜色:前者浅,后者深 |
| D.反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
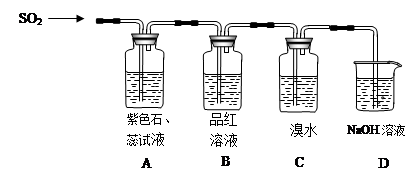
科目:高中化学 来源:不详 题型:填空题
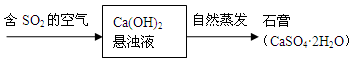
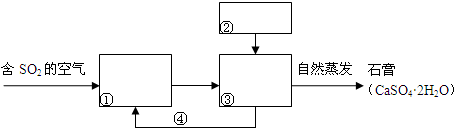
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
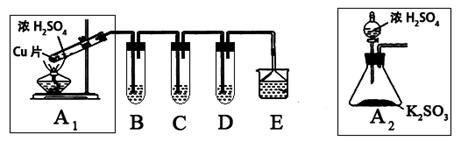
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 ___________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:_______ _______________________ ___________________________________________________ | _________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 =0.7)
=0.7)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2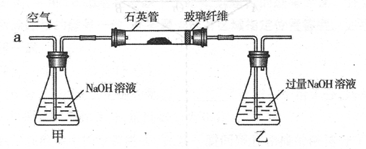
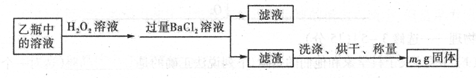
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都是常用的干燥剂 |
| B.常温下都能与氢前金属反应放出氢气 |
| C.一定条件下和铜反应中都表现出强氧化性和强酸性 |
| D.分别露置在空气中,容器内溶质的物质的量浓度都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com