

(2)已知
B.Ksp(CaF2)随钙离子和氟离子浓度的增大而增大
C.该体系最终没有沉淀生成
D.该体系最终有沉淀生成
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(除CO2因逸出而未画)物质的量分数(纵轴)随溶液pH(横轴)变化的情况如下图。

请根据上图所示回答下列问题:
①在同一溶液中,H2CO3、![]() 、
、![]() (填“能”或“不能”) _________________大量共存。
(填“能”或“不能”) _________________大量共存。
②当pH=7时,用一个数学表达式表示溶液中各种离子的物质的量浓度之间的等量关系:_________________。
③已知在![]() (aq)水解反应的平衡常数:
(aq)水解反应的平衡常数:
Kh=![]() =2×10-4 mol·L-1
=2×10-4 mol·L-1
当溶液中c(![]() )∶c(
)∶c(![]() )=2∶1时,溶液的pH=_________________。
)=2∶1时,溶液的pH=_________________。
(1)NO2(g)+CO(g)![]() NO(g)+CO2(g) ΔH=-234 kJ·mol-1
NO(g)+CO2(g) ΔH=-234 kJ·mol-1
(2)C
(3)①不能
②c(Na+)=c(Cl-)+c(![]() )
)
③10
解析:(2)HF的电离平衡常数K为:
K=![]() =3.24×10-9 mol·L-1
=3.24×10-9 mol·L-1
0.2 mol·L-1 HF中c(F-)=![]() mol·L-1=2.55×10-5 mol·L-1
mol·L-1=2.55×10-5 mol·L-1
和CaCl2混合后:Qc=(![]() )2×(
)2×(![]() )=1.62×10-11<Ksp(CaF2)
)=1.62×10-11<Ksp(CaF2)
所以无CaF2沉淀生成
(3)①由图象知H2CO3和![]() 、
、![]() 在pH=8分界线的两侧,所以三者不能大量共存。
在pH=8分界线的两侧,所以三者不能大量共存。
②pH=7时,溶液中不存在![]() ,是NaHCO3、NaCl和H2CO3的混合液,据电荷守恒:
,是NaHCO3、NaCl和H2CO3的混合液,据电荷守恒:
c(Na+)+c(H+)=c(Cl-)+c(![]() )+c(OH-)因为c(H+)+c(OH-),所以c(Na+)=c(
)+c(OH-)因为c(H+)+c(OH-),所以c(Na+)=c(![]() )+c(Cl-)
)+c(Cl-)
③将c(![]() )∶c(
)∶c(![]() )=2∶1代入到Kh表达式中,得c(OH-)=1×10-4 mol·L-1,所以c(H+)=1×10-10 mol·L-1,pH=10。
)=2∶1代入到Kh表达式中,得c(OH-)=1×10-4 mol·L-1,所以c(H+)=1×10-10 mol·L-1,pH=10。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(10 分)(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式________________________;
②甲、乙元素的第一电离能关系为甲 乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为_____________,若使其熔化,需破坏的作用关系为___________________.
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。
①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:填空题
金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体):

(1)在灼烧铝矿时发生化学反应: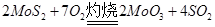 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为________。
(3)写出步骤②中发生反应的离子方程式_________________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化铝,同时检验该反应的氧化产物,根据要求回答下列问题。
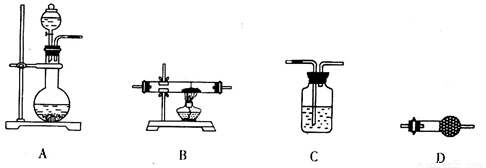
①若两次使用到C装置,则装置D中所盛的药品是________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后______→______→______→______(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
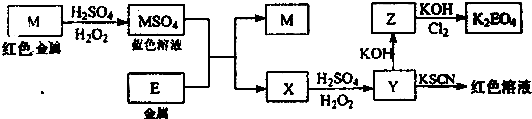
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
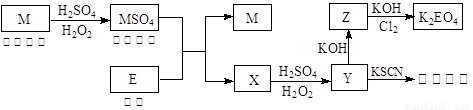
(1)写出M溶于稀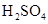 和
和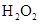 混合液的离子方程式:
。
混合液的离子方程式:
。
(2)检验X中阳离子的方法和现象是 。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有 、 、 (填写仪器名称)。
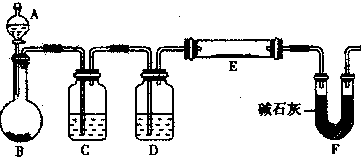
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
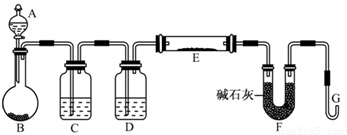
①仪器B中应装入 ,装置D的作用 ;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
在这两步之间还应进行的操作是 ;
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省菏泽市高三第二次模拟考试化学试卷(解析版) 题型:推断题
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,将得到的红色金属M和金属E进行如下框图所示转化,获得高效净水剂K2EO4.(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
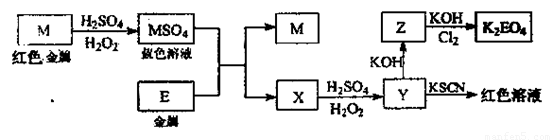
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式 。
(2)检验X中阳离子的方法和现象是 。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。试用离子方程式表示溶液变为蓝色的原因: 。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、烧杯、玻璃棒、漏斗、铁架台外,还需要用到的硅酸盐仪器有 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图。A中试剂是盐酸。
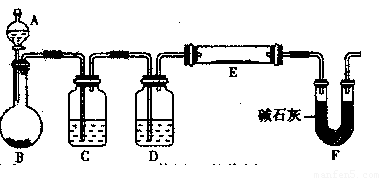
①装置D的作用 ;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”? 在这两步之间还应进行的操作是 。
③该实验设计是否还有不足之处?若有请指出并改进,如没有本问可不答。
(6)试说明K2EO4可用作高效净水剂的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com