
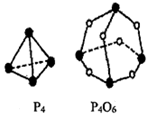
 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
分析 (1)N的核外电子排布式为1s22s22p3,O的核外电子排布式为1s22s22p4,2p电子为稳定结构;F的非金属性最强,非金属性越强,电负性越大;离子的电荷越大、离子半径越小,则晶格能越大;HF分子间含氢键,沸点高;
(2)热化学方程式中,焓变△H=反应物化学键总键能-生成物总键能,注意1molP4中含有6molP-P键,1molP4O6中含有12molP-O键,结合各化学键的键能列式计算热化学方程式P4(s)+3O2(g)═P4O6(s)的反应热△H.
解答 解:(1)N的核外电子排布式为1s22s22p3,O的核外电子排布式为1s22s22p4,2p电子为稳定结构,则第一电离能O<N;F的非金属性最强,非金属性越强,电负性越大,则电负性为Cl<F;离子的电荷越大、离子半径越小,则晶格能越大,则晶格能NaCl>KBr;HF分子间含氢键,沸点高,则沸点为HF>HCl,
故答案为:<;<;>;>;
(2)各化学键键能为P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1,反应热△H=反应物总键能-生成物总键能,所以反应P4(s)+3O2(g)═P4O6(s)的反应热△H=6×E1kJ•mol-1+3×E3kJ•mol-1-12×E2kJ•mol-1=(6E1+3E3-12E2)kJ•mol-1,
故答案为:(6E1+3E3-12E2).
点评 本题考查元素的性质,为高频考点,把握第一电离能、电负性的比较方法为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| B. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| C. | 100mL 1mol/L CH3COONa 溶液中含有的CH3COO-数目为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
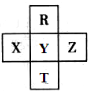 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )| A. | 原子半径 Z>Y>R | B. | R与Y的电子数相差8 | ||
| C. | 非金属性:Z>Y>X | D. | HZO4是目前无机酸中最强的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
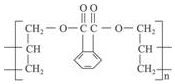 DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )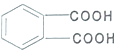
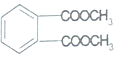
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>H2O>H2S | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:Mg(OH)2>Ca(OH)2>Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com