
【题目】无水FeCl2是常用还原剂,实验室中可以利用反应2FeCl3+C6H5Cl![]() 2 FeCl2+ C6H4Cl2+HCl↑制取,已知:C6H5Cl熔点-45℃,沸点132℃;C6H4Cl2熔点53℃,沸点173℃。下列说法不正确的是( )
2 FeCl2+ C6H4Cl2+HCl↑制取,已知:C6H5Cl熔点-45℃,沸点132℃;C6H4Cl2熔点53℃,沸点173℃。下列说法不正确的是( )
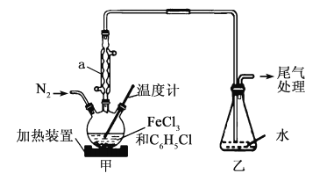
A.仪器a的作用是冷凝、回流、导气
B.反应开始前应向甲中通N2,为防止FeCl2被装置中空气氧化
C.反应结東后,甲中混合物经冷却、过滤、干燥得到纯净的产品
D.最好用油浴加热三颈烧瓶
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请根据题意选择下列物质,并用其字母代号填空:
A.CH3COOC2H5 B.CH2=CH2 C.![]() D.CH3COOH E.C6H12O6 F.(C6H10O5)n
D.CH3COOH E.C6H12O6 F.(C6H10O5)n
(1)属于食醋的主要成分的是___,
(2)具有芳香气味的是___,
(3)可以作为植物生长调节剂的是___,
(4)属于芳香烃的是___,
(5)血糖较低时,可及时补充的是___,
(6)植物的根、茎、叶、果皮主要含有的有机成分是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以进行实验并能达到实验目的的是( )

选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用KMnO4和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与浓硝酸制取并收集纯净干燥的NO2 | 水 | 浓硫酸 |
C | 用生石灰与浓氨水制取并收集纯净干燥的NH3 | 水 | 浓硫酸 |
D | 用铜片和浓硫酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达芦那韦”是抗击新型冠状病毒潜在用药,化合物M是它的合成中间体,其合成路线如下:
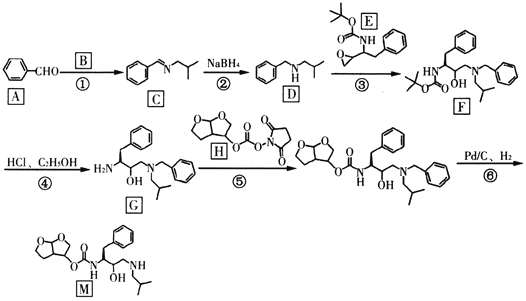
已知:R1CHO![]()
![]()
回答下列问题:
(1)有机物A的名称是______________;反应②反应类型是__________。
(2)物质B的结构简式是____________;E的分子式为_____________。
(3)G中含氧官能团的名称是________;F中有________个手性碳原子。
(4)请写出反应⑤的化学反应方程式_____________。
(5)物质N是C的一种同分异构体,写出满足下列条件的一种同分异构体的结构简式_______。
①分子结构中含有苯环和氨基,氨基与苯环直接相连;②能使溴水褪色;③核磁共振氢谱有6组峰,峰面积之比为6∶3∶2∶2∶1∶1。
(6)设计由苯甲醇和CH3NH2为原料制备![]() 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图1所示。
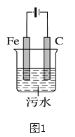
回答下列问题:
(1)电解过程中,电解池阴极的电极反应式为______;控制电流,可使电解池阳极同时发生两个电极反应:其中一个为2H2O -4e- === O2↑+ 4H+,另一个电极反应式为______。
(2)电解池溶液中得到Fe(OH)3沉淀的离子方程式为______。
(3)某熔融盐燃料电池以熔融的多种碱金属碳酸盐混合物为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极,如图2。若该熔融盐燃料电池为电浮选凝聚法的电解电源,则:
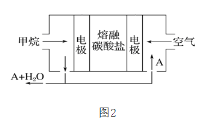
①正极的电极反应式为______;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是______。
③实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池理论上消耗CH4______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.用过量氨水除去烟气中的二氧化硫:SO2+NH3·H2O=![]() +
+![]()
B.过量的Fe和稀硝酸反应:Fe+4H++![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
C.稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
D.实验室用MnO2和浓盐酸制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中存在大量的Na+、Cl-、Cu2+、SO42-,欲除去其中的Cu2+、SO42-,设计工艺流程如图所示:

下列说法不正确的是
A.NaOH的作用是除去Cu2+B.试剂a 为Na2CO3,试剂b为BaCl2
C.流程图中,操作x为过滤D.试剂c为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
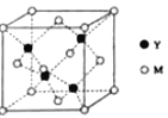
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com