
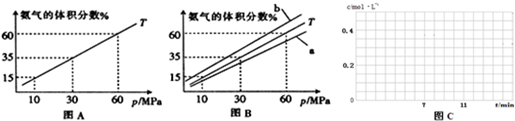
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
| △c |
| △t |
| ||
| 高温高压 |
| 2x |
| 2x+1-x+4-3x |
| 0.33×3 |
| 4 |
| ||
| 高温高压 |
| △c |
| △t |
| ||
| 5min |
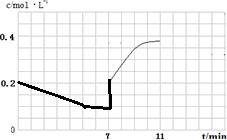 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
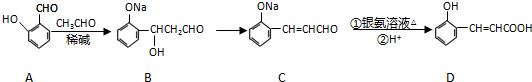
查看答案和解析>>
科目:高中化学 来源: 题型:
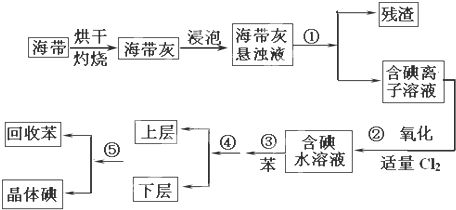
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸铜钡可用氧化物形式表示为BaO?CuO?2SiO2 |
| B、强酸、强碱均可将硅酸铜钡(BaCuSi2O6)完全溶解 |
| C、将CO2通入硅酸钠溶液中,可形成硅酸溶胶 |
| D、泡花碱可以用作防火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定小于92.0 kJ |
| B、一定大于92.0 kJ |
| C、一定等于92.0 kJ |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
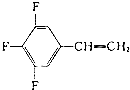 外,还有
外,还有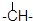 ,n个
,n个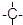 ,其余为-OH,则-OH的个数为
,其余为-OH,则-OH的个数为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com