
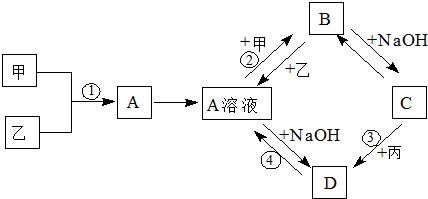
分析 乙为一黄绿色气体所以为氯气,D为一红褐色沉淀说明D为氢氧化铁,结合转化图D是A和氢氧化钠反应生成,所以A一定是含铁的化合物,推断甲为金属铁,A为氯化铁;A和甲反应生成B,是氯化铁和铁反应生成了B为氯化亚铁,B和氢氧化钠反应生成C为氢氧化亚铁沉淀,C和丙气体反应生成D氢氧化铁;所以丙为氧气;综合转化关系分析推断个物质的组成和发生的化学反应.
解答 解:本题的解题关键是乙为一黄绿色气体直接判断为氯气;D为一红褐色沉淀判断为氢氧化铁;结合甲、乙、丙为常见单质,甲常温下为固体,丙为无色气体.A、B、C、D均为化合物,通过转化关系图逐一分析判断个物质的组成和反应;由D是氢氧化铁可知,A+NaOH→Fe(OH)3,推断A是含铁的氯化物,确定A为FeCl3,甲为Fe;转化图中 A+甲→B,是发生了Fe+2Fe3+=3Fe2+,B+NaOH→C,发生的是Fe2++2OH-=Fe(OH)2↓;C+丙→D,发生的反应是:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
综上所述:转化关系中的各物质分别为,
甲:Fe;乙:Cl2;丙:O2;A:FeCl3;B:FeCl2;C:Fe(OH)2;D:Fe(OH)3;
依据上述分析和判断回答下列问题:
(1)乙的化学式为Cl2;B的化学式FeCl2,
故答案为:Cl2;FeCl2;
(2)第③反应的化学方程式是被氧气氧化为氢氧化铁的反应,氧化亚铁化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,反应现象为白色沉淀迅速变为灰绿色,最后变为红褐色沉淀,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;白色沉淀迅速变为灰绿色,最后变为红褐色沉淀;
(3)第②反应的离子方程式是氯化铁和铁发生的氧化还原反应,溶液中反应的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+.
点评 本题考查了氯气、铁及其铁的化合物的 化学性质的应用和现象判断,关键是物质的特殊颜色和特征反应,找到推断物质的题眼是解决问题的突破口.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.0 g氟化氢所含电子数为0.1NA | |
| B. | 1 mol Na2O2 跟足量H2O反应时得到电子的数目为2NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
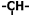 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )| A. | 2个,3个 | B. | 5个,3个 | C. | 4个,6个 | D. | 3个,6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.
 .
. +HBr+CH3Br.
+HBr+CH3Br. 等.
等. 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水, 至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀,后沉淀溶解. |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大,反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大,反应速率慢. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
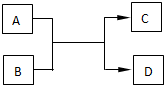 学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.
学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com