
| A. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| B. | 加强碱溶液后加热,滴入酚酞试液,观察溶液颜色 | |
| C. | 加热,将湿润的红色石蕊试纸放在管口观察现象 | |
| D. | 加苛性钠溶液后加热,用湿润的红色石蕊试纸放在试管口进行检验 |
分析 检验铵盐溶液的方法是:铵盐和氢氧化钠在加热条件下生成氨气,氨气能使湿润红色石蕊试纸会变蓝色,由原子守恒来判断为铵盐.
解答 解:A.加水溶解,若有其他的杂质呈酸性,用红色石蕊试纸测其溶液的酸碱性就不可行,故A错误;
B.加强碱溶液后加热,再滴入无色酚酞试液,因为强碱溶液呈碱性,不能确定是否有铵根离子,故C错误;
C、铵盐和水混合不会产生氨气,将湿润的红色石蕊试纸放在试管中会显示红色,是因为铵根离子水解显示酸性,但是显酸性的溶液不一定是铵盐,故B错误;
D.将白色固体放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,证明产生的气体是氨气,则该盐中含有铵根离子,这是检验铵盐的方法,故D正确.
故选D.
点评 本题主要考查了铵盐溶液的检验方法,难度不大,明确铵盐的性质是解本题关键.


科目:高中化学 来源: 题型:选择题
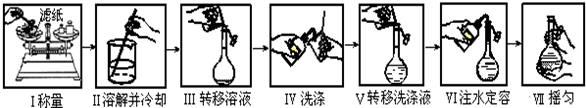
| A. | 如图是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步 | |
| B. | 苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 | |
| C. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 | |
| D. | 在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
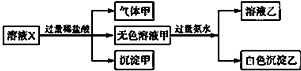
| A. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| B. | HCO3-和SO42-一定不存在于溶液X中 | |
| C. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| D. | 溶液中一定存在大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
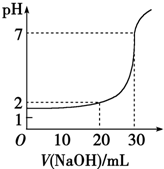 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )| A | B | C | D | |
| c(HCl)/mol•L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH)/mol•L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
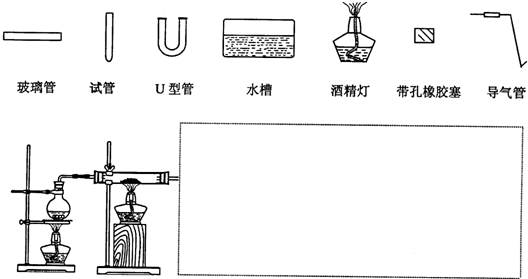
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
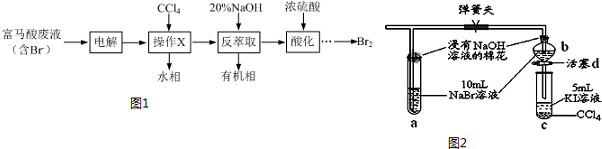
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2中所含的阴离子数为0.2NA | |
| B. | 常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA | |
| C. | 标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA | |
| D. | Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com