
已知分解1molH2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:H2O2→H2O +IO- 慢 H2O2+ IO-→H2O + O2+ I-快。下列有关该反应的说法正确的是
A.反应的速率与I-的浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
证明氟化氢是弱电解质的事实是
A.氟化氢在所有卤化氢中热稳定性最强
B.浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生
C.100 mL0.1mol/L氢氟酸中c(H+)小于0.1mol/L
D.测得常温下0.1mol/LNaF溶液的pH>7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
如果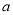 g某气体中含有的分子数为
g某气体中含有的分子数为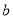 ,则
,则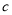 g该气体在标准状况下占有的体积应表示为(式中
g该气体在标准状况下占有的体积应表示为(式中 为阿伏加德罗常数)
为阿伏加德罗常数)
A. B.
B.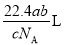 C.
C.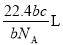 D.
D.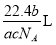
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
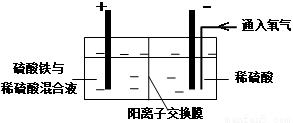
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
如图是CO2电催化还原为CH4的工作原理示意图,下列说法不正确的是

A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e- =CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH 一定下降
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:实验题
研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
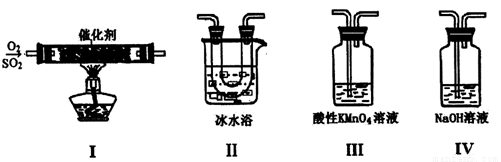
(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为____________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:选择题
相同质量的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,二者比较相等的是( )
①铜片消耗完所需时间
②反应中氧化剂得到电子的总数
③反应生成气体的体积(同温、同压)
④反应后溶液中铜离子浓度
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期期中化学试卷(解析版) 题型:实验题
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。从铝土矿中提炼Al2O3的流程如下:
回答下列问题:
(1)写出反应1的化学方程式 。
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 。
(3)图中多次涉及过滤操作,过滤时需要使用的玻璃仪器除漏斗外还有 。
(4)请写出检验滤渣Ⅰ中含有铁元素的实验方法(要求简要的实验步骤、现象和结论)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com