
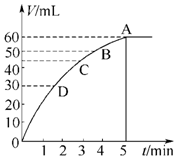
分析 (1)反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)图象中曲线的斜率表示化学反应速率,斜率越大其反应速率越大;
(4)反应物浓度越大反应速率越大,即反应物浓度与反应速率成正比;
(5)根据氧气和过氧化氢之间的关系式计算过氧化氢浓度.
解答 解:(1)反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积为60mL,故答案为:60mL;
(2)反应放出气体体积为气体总体积一半为30mL,根据图知,生成氧气体积为30mL时需要的时间约为2min,
故答案为:2min;
(3)图象中曲线的斜率表示化学反应速率,斜率越大其反应速率越大,根据图知,斜率大小顺序是D>C>B>A,所以反应速率大小顺序是D>C>B>A,故答案为:D>C>B>A;
(4)反应物浓度越大反应速率越大,即反应物浓度与反应速率成正比,随着反应进行,双氧水浓度越来越小,则反应速率越来越小,故答案为:随着反应进行双氧水浓度逐渐减小,则反应速率逐渐减小;
(5)设双氧水物质的量浓度为xmol/L,则n(H2O2)=0.05xmol,根据2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑知,n(H2O2)=2(O2)=2×$\frac{0.06L}{22.4L/mol}$=0.05xmol,x=0.11,
故答案为:0.11mol/L.
点评 本题考查化学反应速率影响因素、化学方程式有关计算等知识点,为高频考点,侧重考查学生分析、判断及计算能力,明确该图象中曲线斜率含义是解本题关键,会利用运用关系式进行计算,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、Br-、SO42- | B. | Na+、Ca2+、HCO3-、OH- | ||
| C. | Al3+、NH4+、SO42-、Cl- | D. | Na+、H+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的NH4Cl固体 | ||
| C. | 加入等体积0.2mol•L-1NaOH溶液 | D. | 提高溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 2.0mol/L | D. | 3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═Cl-+ClO+2H+ | |
| B. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Fe与盐酸反应制H2:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、Cl-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | |||
| Y | Z |
| A. | X能分别与Y、W形成化合物,且其所含化学键类型完全相同 | |
| B. | W有多种同素异形体,且均具有高熔点、高沸点的性质 | |
| C. | X的离子半径一定小于Y同族的短周期元素的离子半径 | |
| D. | Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com